Methacryloylchlorid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methacryloylchlorid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H5ClO | ||||||||||||||||||
| Kurzbeschreibung |
farblose, beißend riechende Flüssigkeit[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 104,53 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
löslich in Diethylether, Aceton und Chloroform,[4] in Tetrahydrofuran, 1,4-Dioxan, Cyclohexan, n-Hexan[5] | ||||||||||||||||||
| Brechungsindex | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Methacryloylchlorid oder 2-Methyl- 2-propenoylchlorid ist wie das verwandte Acryloylchlorid eine α,β-ungesättigte Carbonylverbindung und als Chlorid der Methacrylsäure bzw. als Carbonsäurechlorid und funktionales Alken besonders reaktiv. Mit Wasser reagiert Methacryloylchlorid heftig unter Bildung von Methacrylsäure und Salzsäure und polymerisiert bei Temperaturerhöhung spontan.[1][7]
Wegen seiner Giftigkeit, Entzündbarkeit und Korrosivität muss Methacryloylchlorid (wie Acryloylchlorid) mit großer Vorsicht gehandhabt werden.
Herstellung
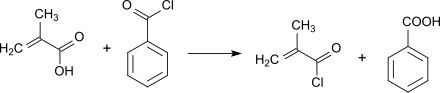
[Bearbeiten | Quelltext bearbeiten]Methacrylsäure reagiert mit anorganischen Säurechloriden, wie Thionylchlorid[8] (Ausbeute 58–70 %), Phosphortrichlorid[9] (keine Angabe der Ausbeute) oder mit organischen Säurechloriden, wie Benzoylchlorid (Ausbeute 85–90 %)[10] bzw. in 65%iger Ausbeute[11] zu Methacryloylchlorid, dessen destillative Reinigung in Gegenwart von Polymerisationsinhibitoren wie Kupfer(I)-chlorid oder Hydrochinon durchgeführt wird.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Methacryloylchlorid ist eine klare, farblose, leicht flüchtige Flüssigkeit mit stechendem Geruch, deren Dämpfe tränenreizend und leicht entzündlich sind und mit Luft explosionsfähige Gemische bilden.
In Wasser hydrolysiert Methacryloylchlorid in stark exothermer Reaktion zu Methacrylsäure und Salzsäure und wirkt sehr giftig beim Einatmen, korrosiv und ätzend und sensibilisierend bei Hautkontakt.
Methacryloylchlorid muss daher in fest verschlossenen, lichtundurchlässigen Gefäßen trocken bei 2–8 °C gelagert und wegen seiner Polymerisationsneigung mit wirksamen Mengen eines Polymerisationsinhibitors, z. B. 200 ppm Butylhydroxytoluol (BHT)[3], 400 ppm Hydrochinonmonomethylether (MEHQ)[2] oder 200 ppm Phenothiazin[6] stabilisiert werden.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Reaktionen mit niedermolekularen Verbindungen
[Bearbeiten | Quelltext bearbeiten]Methacrylsäurechlorid eignet sich wegen seiner Reaktivität gegenüber Nucleophilen zur Bildung von Methacrylsäureestern und -amiden und zur Einführung der Methacryloylgruppe als polymerisierbare Einheit in hydroxyl-, mercapto- und aminogruppentragende niedermolekulare Verbindungen und in Polymere im Sinne polymeranaloger Reaktionen.
Methacrylsäureester werden in brauchbaren bis hohen Ausbeuten (74–98 %) bei der Reaktion von Methacryloylchlorid mit höheren aliphatischen Alkoholen und Phenolen in Gegenwart von Molekularsieben erhalten.[12] Mit Dimethylaminoalkanolen, wie z. B. Dimethylaminoethanol (DMAE), oder den längerkettigen Homologen 6-Dimethylaminohexanol oder 10-Dimethylaminodecanol werden die entsprechenden Methacrylsäureester gebildet, die als funktionale Comonomere mit pH-abhängiger Ladung (–NH2 + H+ → –NH3+) von Interesse sind.[13]

Methacryloylchlorid reagiert mit Monoethanolamin-Hydrochlorid in Tetrahydrofuran in 81%iger Ausbeute zu dem Ester 2-Aminoethylmethacrylat-Hydrochlorid, einem weißen, kristallinen Feststoff.[14] Mit dem freien Amin Monoethanolamin hingegen reagiert Methacryloylchlorid in Methanol und in Gegenwart von Triethylamin bzw. wässr. Kaliumhydroxid zu dem Amid N-(2-Hydroxyethyl)methacrylamid (HEMAm), einer farblosen Flüssigkeit.[15][16]

Hydrophile Methacrylsäureester und -amide eignen sich als Monomere und Comonomere für hydrophile Polymere, die sich durch gute Bioverträglichkeit auszeichnen. So erweisen sich Polysulfon-Membranen, auf die hydrophile Methacrylamide – durch Umsetzung von Methacryloylchlorid mit einer Reihe hydrophiler Amine erhalten – aufgepfropft wurden z. T. als besonders resistent gegenüber Proteinadhäsion, der Hauptursache für das in der Praxis außerordentlich problematische Membranfouling.[17]
Methacryloylchlorid dimerisiert bei längerem Stehen, auch bei niedrigen Temperaturen, in einer oxa-Diels-Alder-Reaktion zu einem Dihydropyran-Derivat, das beim Stehen an feuchter Luft zur 2,5-Dimethyl-2-hydroxyadipinsäure – einer weißen, kristallinen und wasserlöslichen Verbindung – hydrolysiert wird.[18]

Mit Spuren von Lewis-Säuren isomerisiert das Dimere zu einem Gemisch von 2-Oxocyclopentancarbonylchloriden.
Polymeranaloge Reaktionen
[Bearbeiten | Quelltext bearbeiten]Ein Grenzfall einer polymeranalogen Reaktion ist die Umsetzung von Methacryloylchlorid mit Polyethylenglycolmonoethern (MPEGs),[19] bei der die endständige Hydroxygruppe des linearen MPEGs zu einem Methacrylat-Makromonomer funktionalisiert wird.

Copolymere der erhaltenen Makromonomeren mit Methacrylsäureestern adsorbieren aus wässriger Lösung an Oberflächen von hydrophobe Polymeren, wie Polyolefine, z. B. LDPE oder (Meth)acrylate. Sie reduzieren die Proteinadsorption und lösen adsorbierte Proteine von Polymeroberflächen ab.[20]
Die hohe Reaktivität des Methacryloylchlorids ermöglicht den Einbau von Methacrylatgruppen in freie hydroxyl- und aminogruppentragende Polymere, wie z. B. Polyvinylalkohol[21], Poly(2-hydroxyethylmethacrylat) (PolyHEMA)[22] (folgende Reaktionsgleichung) oder Gelatine.[23]

Die durch polymeranaloge Umsetzung erhaltenen methacrylatmodifizierten hydrophilen Polymere können mit UV-Licht vernetzt werden und bilden Hydrogele, die wegen ihrer relativ guten Biokompatibilität für weiche Kontaktlinsen, Implantate, Wirkstoffdepots oder als Gerüstmaterial Verwendung finden.
Homo- und Copolymere
[Bearbeiten | Quelltext bearbeiten]Freie radikalische Polymerisation von Methacryloylchlorid führt zu Poly(methacryloylchlorid)[5][24], einer festen, farblosen und leicht klebrigen Substanz, die leicht mit Alkoholen und Aminen in polymeranalogen Reaktionen zu den entsprechenden Poly(methacrylaten) und Poly(methacrylamiden) umgesetzt werden kann. Allerdings konnte nur in Cyclohexan und n-Hexan eine brauchbare Polymerausbeute (45 %) mit sehr hohem Polymerisationsgrad erzielt werden.

Die radikalische Polymerisation von Methacryloylchlorid mit anderen Alkenmonomeren verläuft in Substanz oder in Lösung zu Copolymeren, aus denen durch polymeranaloge Umsetzungen an den Säurechloridgruppen funktionalisierte Makromoleküle mit besonderen (z. B. optischen) Eigenschaften zugänglich sind.
1. Radikalische Copolymerisation
Methacryloylchlorid kann z. B. mit Methylmethacrylat copolymerisiert werden.[25] Die erhaltenen Copolymere können anschließend in einer polymeranalogen Reaktion an der eingeführten Säurechloridgruppe mit nicht-linear optischen (NLO) Chromophoren, in diesem Fall mit funktionellen Azobenzol-Derivaten, zu Copolymeren mit NLO-Eigenschaften für optische Bauelemente funktionalisiert werden.
2. RAFT Copolymerisation
Auch durch RAFT-Polymerisation von Methacryloylchlorid mit Alkenen, wie z. B. Styrol und Kettenübertragungsmitteln (englisch chain transfer agent, CTA), wie z. B. S-Dodecyl-S’-(α’-dimethyl-α’’-essigsäure)trithiocarbonat (DDMAT), können definierte Copolymere dargestellt werden.[26]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Eintrag zu 2-Methylpropenoylchlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- ↑ a b c Datenblatt Methacrylsäurechlorid, 97%, stab. with ca. 400 ppm 4-methoxyphenol bei Alfa Aesar, abgerufen am 5. Dezember 2014 (Seite nicht mehr abrufbar).
- ↑ a b c d Datenblatt Methacrylsäurechlorid bei Sigma-Aldrich, abgerufen am 21. Mai 2017 (PDF).
- ↑ a b c D.R. Lide: Handbook of Chemistry and Physics, 76th ed., 1995-1996. CRC Press, Boca Raton, 2010, ISBN 978-0-8493-0476-7, S. 3–293.
- ↑ a b P.E. Blatz: Polymerization of methacryloyl chloride in selected solvents. In: Polym. Eng. Sci. Band 3, Nr. 1, 1963, S. 67–70, doi:10.1002/pen.760030114.
- ↑ a b Framochem, Safety Data Sheet Methacryloylchlorid ( vom 21. Dezember 2014 im Internet Archive)
- ↑ J. Frazier: Surprise polymerization of methacryloyl chloride. In: Chem.&Eng. News. Band 74, Nr. 23, S. 4 (online).
- ↑ J. Lal, R. Green: The preparation of some esters of methacrylic acid. In: J. Org. Chem. Band 20, Nr. 8, 1955, S. 1030–1033, doi:10.1021/jo01365a013.
- ↑ S.R. Dave, Ph.D. Thesis, 2012, PDF
- ↑ S. Patai, M. Bentov, M.E. Reichmann: Preparation and Polymerization of Aryl Methacrylates and N-Arylmethacrylamides. In: J. Am. Chem. Soc. Band 74, Nr. 3, 1952, S. 845–847, doi:10.1021/ja01123a523.
- ↑ Y.S. Bharathi, M.M. Reddy, G.R. Reddy, S.V. Naidu: Synthesis, Characterization and Compatibility studies of Homopolymers of Poly (Carboxy Phenyl Acrylate) and Poly (Carboxy Methyl Phenyl Acrylate). In: Malays. Polym. J. Band 5, Nr. 1, 2010, S. 95–108 (researchgate.net).
- ↑ Patent US4258204: Acrylate ester monomer production. Angemeldet am 24. November 1978, veröffentlicht am 4. März 1981, Anmelder: University Patents, Inc., Erfinder: A.R. Banks, R.F. Fibiger, T. Jones.
- ↑ P.C. Soon, L.G. Xu, S.C. Ng: Synthesis and characterization studies of novel reactive polymers
- ↑ K.L. Deng, H. Tian, P.F. Zhang, X.B. Ren, H.B. Zhong: Synthesis and characterization of a novel temperature-pH-responsive copolymer of 2-hydroxypropyl acrylate and aminoethyl methacrylate hydrochloric salt. In: eXPRESS Polymer Letters. Band 3, Nr. 2, 2009, S. 97–104, doi:10.3144/expresspolymlett.2009.13.
- ↑ Ali Ghadban: Synthèse et caractérisation de glycopolymères à base d’oligoalginates en milieu aqueux, Ph.D. Thesis, Agricultural sciences, Université de Grenoble, 2012.
- ↑ J. Song, E. Saiz, C.R. Bertozzi: A New Approach to Mineralization of Biocompatible Hydrogel Scaffolds: An Efficient Process toward 3-Dimensional Bonelike Composites. In: J. Am. Chem. Soc. Band 125, Nr. 5, 2003, S. 1236–1243, doi:10.1021/ja028559h.
- ↑ M. Gu, A.J. Vegas, D.G. Anderson, R.S. Langer, J.E. Kilduff, G. Belfort: Combinatorial synthesis with high throughput discovery of protein-resistant membrane surfaces. In: Biomaterials. Band 34, Nr. 26, 2013, S. 6133–6138, doi:10.1016/j.biomaterials.2013.04.051.
- ↑ J. Warneke, Z. Wang, M. Zeller, D. Leibfritz, M. Plaumann, V.A. Azov: Methacryloyl chloride dimer: from structure elucidation to a manifold of chemical transformations. In: Tetrahedron. Band 70, Nr. 37, 2014, S. 6515–6521, doi:10.1016/j.tet.2014.07.019.
- ↑ Ineos Oxide: Methoxy Polyethylene Glycols, Technical Data Sheet.
- ↑ Patent US5075400: Polymer supersurfactants for protein resistance and protein removal. Angemeldet am 14. März 1990, veröffentlicht am 24. Dezember 1991, Anmelder: University of Utah, Erfinder: J.D. Andrade, J. Kopecek, J.H. Lee.
- ↑ R. Jantas, S. Połowiński: Esterification of poly(vinyl alcohol) with methacryloyl chloride. In: Acta Polym. Band 35, Nr. 2, 1984, S. 150–152, doi:10.1002/actp.1984.010350208.
- ↑ L. Yu, G. Urban, I. Moser, G. Jobst, H. Gruber: Photolithographically patternable modified poly(HEMA) hydrogel membranes. In: Polym. Bull. Band 35, Nr. 6, 1995, S. 759–765, doi:10.1007/BF00294960.
- ↑ J.W. Nichol, S.T. Koshy, H. Bae, C.M. Hwang, S. Yamanlar, A. Khademhosseini: Cell-laden microengineered gelatin methacrylate hydrogels. In: Biomaterials. Band 21, 2010, S. 5536–5544, doi:10.1016/j.biomaterials.2010.03.064.
- ↑ H.R. Kricheldorf, O. Nuyken, G. Swift (Hrsg.): Handbook of Polymer Synthesis. 2nd ed. M. Dekker, 2005, ISBN 0-8247-5473-5, S. 286–288.
- ↑ Patent EP0514750A1: Verfahren zur Herstellung von Polymeren mit NLO-aktiven Seitengruppen und deren Verwendung. Angemeldet am 13. Mai 1992, veröffentlicht am 25. November 1992, Anmelder: BASF AG, Erfinder: H. Kilburg, K.-H. Etzbach, K.H. Beck, P. Strohrieg, H. Müller, O. Nuyken.
- ↑ M. Seo, M.A. Hillmyer: RAFT copolymerization of acid chloride-containing monomers. In: Polym. Chem. Band 5, 2014, S. 213–219, doi:10.1039/C3PY00867C.


