Methyl-2,3,4,6-tetra-O-benzyl-α-D-glucopyranosid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
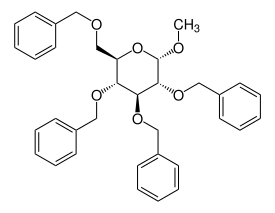
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methyl-2,3,4,6-tetra-O-benzyl-α-D-glucopyranosid | ||||||||||||||||||
| Summenformel | C35H38O6 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 554,67 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Methyl-2,3,4,6-tetra-O-benzyl-α-D-glucopyranosid ist eine chemische Verbindung, die sich von der Glucose ableitet. Es ist als Zwischenprodukt in der organischen Synthese von Bedeutung.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Die Synthese von Methyl-2,3,4,6-tetra-O-benzyl-α-D-glucopyranosid wurde erstmals 1960 von Otto Theodor Schmidt et al. publiziert. Hierzu wurde das Edukt Methyl-α-D-glucopyranosid mit Benzylchlorid und Natriumhydroxid umgesetzt. Die Hydroxygruppen des Zuckers und Benzylchlorid reagieren dabei im Sinne einer Nukleophile Substitution ab.[2]

Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Methyl-2,3,4,6-tetra-O-benzyl-α-D-glucopyranosid kann durch Säulenchromatographie mit einem Eluent der Zusammensetzung Benzol:Diethylether 40:1[3] oder Benzol:2-Butanon 30:1 aus den Produktgemischen isoliert werden.[4]
Nach Koto et al. 1982
[Bearbeiten | Quelltext bearbeiten]Methyl-2,3,4,6-tetra-O-benzyl-α-D-glucopyranosid kann auch durch Titan(IV)-chlorid-vermittelte Epimerisierung aus der entsprechenden β-Verbindung gewonnen werden. Dieser Prozess ist innerhalb von wenigen Sekunden bzw. Minuten beendet und das Produktgemisch besteht nur noch zu 4 % aus der β-Verbindung.[4]

Nach Szeja 1988
[Bearbeiten | Quelltext bearbeiten]2,3,4,6-Tetra-O-benzyl-α-D-glucopyranose[5] wird mit Methanol glykosyliert. Um den Prozess zu begünstigen, wird in einem 2-Phasen-Medium gearbeitet. Die wässrige Phase ist eine konzentrierte Natriumhydroxid-Lösung und die chlororganische Phase besteht aus Dichlormethan mit Tosylchlorid. Als Phasentransferkatalysator dient Benzyltriethylammoniumchlorid (TEBAC bzw. hier „TEBA“). Bei diesem Prozess entsteht zunächst intermediär ein Anomerengemisch der 1-tosylierten Form des Zuckers. Daher wird auch schlussendlich ein solches Gemisch des Produktes erhalten. Die α-Form überwiegt dabei mit 75 %.[3]

Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Methyl-2,3,4,6-tetra-O-benzyl-α-D-glucopyranosid (PDF) bei BLD Pharmatech, Katalognummer: BD138056, abgerufen am 27. August 2022.
- ↑ O. Th. Schmidt, T. Auer, H. Schmadel: 2.3.4.6-Tetrabenzyl-α-D-glucose. In: Chemische Berichte. Band 93, Nr. 2, 1960, S. 556–557, doi:10.1002/cber.19600930247.
- ↑ a b W. Szeja: A convenient synthesis of α-D-glucopyranosides. In: Synthesis. Nr. 3, 1988, S. 223–224, doi:10.1055/s-1988-27519.
- ↑ a b S. Koto, N. Morishima, R. Kawahara, K. Ishikawa, S. Zen: A study of the rapid anomerization of poly-O-benzyl-β-D-glucopyranosides with titanium tetrachloride. In: Bulletin of the Chemical Society of Japan. Band 55, Nr. 4, 1982, S. 1092–1096, doi:10.1246/bcsj.55.1092.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,3,4,6-Tetra-O-benzyl-α-D-glucopyranose: CAS-Nr.: 6564-72-3, EG-Nr.: 667-304-9, ECHA-InfoCard: 100.193.295, PubChem: 11731256, ChemSpider: 9905972, Wikidata: Q72504581.
