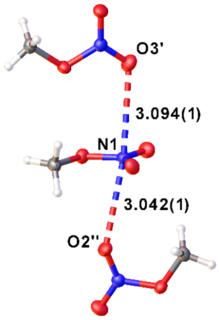Methylnitrat
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Methylnitrat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CH3NO3 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 77,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
1,21 g·cm−3[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
64,6 °C[1] | ||||||||||||||||||
| Löslichkeit |
wenig in Wasser[3] | ||||||||||||||||||
| Brechungsindex |
1,3748 (20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−156,3 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Methylnitrat ist der einfachste organische Ester der Salpetersäure und kann aus dieser durch die Veresterung mit Methanol gewonnen werden.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Eine erste Erwähnung findet sich als das berühmte und geheimnisumwitterte Schießwasser in einem Feuerwerkbuch von 1420, auch wenn seine chemische Natur damals nicht erkannt wurde.[6] Chemiehistorische Arbeiten klärten, dass nur das Methylnitrat mit seinem Herstellungs- und Explosionspotential in Frage kommen kann.[7][8] Der Text im Feuerwerkbuch von 1420 ist in Ausschnitten wie folgt:
"Wildu mit wasser schyessen // daß du kein pulfer prauch // est vnd sterker und waiter // mit schewst dann als du daß aller // pest pulfer hast das yemann gehab // en mag und ye gemacht wurd so ny // salpeter und distillier den mit wasser // vnd nym oleo benedicto dazu auch … // … vnd zunt sie an mit sinnen das du davon kommen magst … // …mit disem wasser schewst du dreytousent schrit weit … // … es ist gar köstlich…"
Eine frühe gezielte Synthese wurde vom US-amerikanischen Chemiker Matthew Carey Lea im Jahr 1862 veröffentlicht.[9]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Methylnitrat ist ein Explosivstoff, der durch vorsichtige Veresterung von Methanol mit einem Salpetersäure/Schwefelsäure-Gemisch, auch unter dem Namen Nitriersäure bekannt, unter starker Kühlung hergestellt wird[3]:
Daneben entsteht es auch schon bei vorsichtigem Abdestillieren aus einer Mischung aus 65%iger Salpetersäure mit Methanol unter Zusatz von wenig Harnstoff, der durch Bindung von nitrosen Gasen Zersetzungen bis hin zur Explosion verhindert.[10][3] Eine Laborsynthese gelingt durch die Umsetzung von Methyliodid mit Silbernitrat bei Raumtemperatur.[11]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Methylnitrat ist eine farblose, chloroformartig riechende Flüssigkeit, die bei Normaldruck bei 66 °C siedet.[12] Die molare Verdampfungsenthalpie am Siedepunkt beträgt 28,673 kJ·mol−1.[12] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in Torr, T in °C) mit A = 7,34608, B = 1351,0264 und C = 237,714 im Temperaturbereich von −24,82 bis 88,27 °C.[13] Die Verbindung hat eine Dichte von 1,21 g·cm−3 und eine erhebliche Brisanz. Methylnitrat ist eine wasserklare Flüssigkeit mit starkem, aromatischem Geruch, die schnell heftige Kopfschmerzen verursacht. Die Schlagempfindlichkeit ist geringer als die von Glycerintrinitrat (Nitroglycerin), die Flüchtigkeit jedoch deutlich höher.
Struktur
[Bearbeiten | Quelltext bearbeiten]Die Struktur von Methylnitrat wurde experimentell in der Gasphase (kombinierte Gas-Elektronenbeugung und Mikrowellespektrsokopie, GED/MW) und im kristallinen Zustand (Röntgenbeugung, XRD) untersucht (siehe Abbildung und Tabelle 1).[11] Im Festkörper existieren schwache Wechselwirkungen zwischen den O- und N-Atomen unterschiedlicher Moleküle (siehe Abbildung).

| Parameter | ||
| XRD | GED/MW | |
| C–O | 1.451(1) | 1.425(3) |
| N–OC | 1.388(1) | 1.403(2) |
| N–Oterminal | 1.204(1) | 1.205(1) |
| C–O–N | 113.3(1) | 113.6(3) |
| Oterminal-N-Oterminal | 128.6(1) | 131.4(4) |
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Die Sprengkraft ist ähnlich dem Nitroglycerin, auch gelatiniert die Substanz zusammen mit Nitrozellulose, so dass sich Alfred Nobel bei der Beschreibung der Sprenggelatine auch die analoge Mischung mit Methylnitrat schützen ließ, die aber wegen der Flüchtigkeit nie technisch verwendet wurde. Die Dämpfe des Methylnitrats sind auch ohne Luftzutritt äußerst explosiv, was im 19. Jahrhundert bei der zeitweiligen Herstellung der Substanz als Zwischenprodukt zur Farbstoffsynthese zu mehreren Explosionskatastrophen führte (z. B. in St. Denis, 1874). In einer offenen Schale ohne vorherige Verdunstung brennt das Methylnitrat ruhig ab, bei Zündung in einem Reagenzglas erfolgt Explosion, ohne dass ein Initialzünder nötig wäre. Wichtige Explosionskennzahlen sind:
- Explosionswärme: 6754 kJ·kg−1 [H2O (l)], 6055 kJ·kg−1 [H2O (g)][3]
- Detonationsgeschwindigkeit: 6300 m·s−1 bei der einer Dichte von 1,217 g·cm−3[3]
- Normalgasvolumen: 909 l·kg−1[3]
- Spezifische Energie: 1301 kJ·kg−1[3]
- Verpuffungspunkt: schnelle Verdampfung ohne Entzündung[3]
- Bleiblockausbauchung: 610 cm3/10 g[3]
- Schlagempfindlichkeit: 0,2 N·m[3][11]
- Reibempfindlichkeit: 353 N[11]
- Stahlhülsentest: Grenzdurchmesser 18 mm[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Wegen seiner Empfindlichkeit hat Methylnitrat keine praktische Bedeutung als Sprengstoff gefunden, jedoch als Mischung mit einem Gehalt von 25 % Methanol fand es unter dem Namen Myrol im Dritten Reich Verwendung als Raketentreibstoff und volumetrischer Sprengstoff.[3][14]
Nach A. Stettbacher[15] diente die Substanz 1933 als Brandstoff beim Reichstagsbrand.
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu Salpetersäureester. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. Mai 2014.
- ↑ a b David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-360.
- ↑ a b c d e f g h i j k l Köhler, J.; Meyer, R.; Homburg, A.: Explosivstoffe, zehnte, vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- ↑ Feuerwerkbuch von 1420 (anonym), Stainer, Augsburg, 1529.
- ↑ Wilhelm Hassenstein, Hermann Virl: Das Feuerwerkbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdruckes aus dem Jahr 1529 mit Übertragung ins Hochdeutsche und Erläuterungen von Wilhelm Hassenstein. Verlag der Deutschen Technik, München 1941, hier: S. 81 f. und 127 f.
- ↑ J. Gartz: Vom griechischen Feuer zum Dynamit – eine Kulturgeschichte der Explosivstoffe. E. S. Mittler & Sohn, Hamburg, 2007, ISBN 978-3-8132-0867-2.
- ↑ Lea, M.C.: Ueber die Bereitung der Salpetersäure-Methyläther und der Methylbasen in Chemisches Zentralblatt 1862, 602–604, Link Digitale Sammlungen.
- ↑ R.I. Bialke: Initialsprengstoffe und Anzündmittel - Synthesen verschiedener Initialsprengstoffe und die Beschreibung der Herstellung von deren Anzündmittel, Books on Demand GmbH, Norderstedt ISBN 978-3-837-077827, S. 37.
- ↑ a b c d Marco Reichel, Burkhard Krumm, Yury V. Vishnevskiy, Sebastian Blomeyer, Jan Schwabedissen, Marco Reichel, Hans‐Georg Stammler, Konstantin Karaghiosoff, Norbert W. Mitzel: Festkörper- und Gasphasenstrukturen sowie energetische Eigenschaften des gefährlichen Methyl- und Fluormethylnitrats. In: Angewandte Chemie. Band 131, Nr. 51, 2019, S. 18730–18734, doi:10.1002/ange.201911300. open access.
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 1st Edition Elsevier 2008, ISBN 978-0815515968, S. 411.
- ↑ Carl L. Yaws: The Yaws Handbook of Vapor Pressure - Antoine Coefficients, 2st Edition Elsevier 2015, ISBN 978-0-12-802999-2, S. 3, doi:10.1016/B978-0-12-802999-2.00004-0.
- ↑ Koch, E.-C.: Sprengstoffe, Treibmittel, Pyrotechnika, 2. Auflage, de Gruyter, Berlin/Boston 2019, ISBN 978-3-11-055784-8, S. 396, (abgerufen über De Gruyter Online).
- ↑ A. Stettbacher: Spreng- und Schießstoffe. Rascher Verlag, Zürich 1948.