Molybdän(V)-fluorid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ Mo5+ _ F− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Molybdän(V)-fluorid | ||||||||||||
| Andere Namen |
Molybdänpentafluorid | ||||||||||||
| Verhältnisformel | MoF5 | ||||||||||||
| Kurzbeschreibung |
gelber Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 190,94 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
3,5 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Siedepunkt |
212 °C[2] | ||||||||||||
| Löslichkeit | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Molybdän(V)-fluorid ist eine anorganische chemische Verbindung des Molybdäns aus der Gruppe der Fluoride.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Molybdän(V)-fluorid kann durch Reaktion von Molybdänhexacarbonyl mit Fluor bei −78 °C gewonnen werden.[1]
Alternativ erfolgt die Darstellung durch Umsetzung von elementarem Molybdän mit Molybdän(VI)-fluorid bei 60 °C mit einer Ausbeute von 75 – 80 %[4]:
Eigenschaften
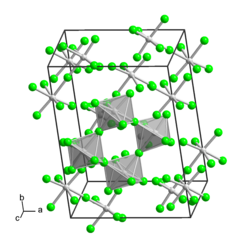
[Bearbeiten | Quelltext bearbeiten]Molybdän(V)-fluorid ist ein gelber, hydrolyseempfindlicher Feststoff, der an der Luft raucht.[1] Seine Kristallstruktur kann als zyklisches Tetramer [MoF5]4 aus verzerrten Oktaedern beschrieben werden. Es handelt sich um den Namensgeber des MoF5-Strukturtyps.[6]
Die in der Literatur angegebene Schmelztemperatur von über 60 °C widerspricht neueren sowohl thermographisch als auch visuell in einer dünnwandigen Quarzkapillare ermittelten Werten von etwa 45 °C. Das Fehlen einer vollständigen chemischen Analyse in den älteren Quellen legt das Vorhandensein von Beimischungen von Molybdän(VI)-oxidfluorid MoOF4 (Schmelzpunkt 98 °C) in den synthetisierten Zubereitungen nahe, was den Schmelzpunkt erheblich erhöhen kann.[3][7]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band 1. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 266.
- ↑ a b webelements: Periodic Table of the Elements | Molybdenum | tetramolybdenum_eicosafluoride
- ↑ a b Ya. V. Vasil'ev, A. A. Opalovskii, K. A. Khaldoyanidi: Magnetic properties of molybdenum pentafluoride. In: Bulletin of the Academy of Sciences of the USSR Division of Chemical Science. 18, 1969, S. 231, doi:10.1007/BF00905525.
- ↑ a b c T. J. Ouellette et al.: Molybdenum(V) fluoride (Molybdenum pentalfluoride). In: F. A. Cotton (Hrsg.): Inorganic Syntheses. Band 13. McGraw-Hill Book Company, Inc., 1972, ISBN 07-013208-9 (defekt), S. 146–1150 (englisch).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ A. J. Edwards, R. D. Peacock, R. W. H. Small: The Preparation and Structure of Molybdenum Pentafluoride. In: J. Chem. Soc. 1962, S. 4486–4491.
- ↑ Ralph F. Krause, Thomas B. Douglas: The melting temperature, vapor density, and vapor pressure of molybdenum pentafluoride. In: The Journal of Chemical Thermodynamics. 9, 1977, S. 1149, doi:10.1016/0021-9614(77)90116-1.

![{\displaystyle {\ce {Mo + 5 MoF6 ->[T][]6 MoF5}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d1b806b66b3af8d451dface9977cdc679d84ea78)