Natriumphosphid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
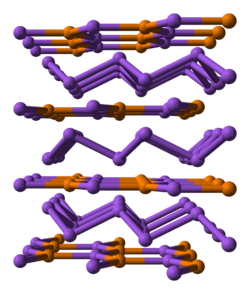
| ||||||||||||||||
| _ Na+ _ P3− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumphosphid | |||||||||||||||
| Andere Namen |
Trinatriumphosphid | |||||||||||||||
| Verhältnisformel | Na3P | |||||||||||||||
| Kurzbeschreibung |
roter Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 99,94 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
1,74 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Natriumphosphid (genauer Trinatriumphosphid) ist eine anorganische chemische Verbindung des Natriums aus der Gruppe der Phosphide. Neben Na3P sind mit NaP, Na3P7, Na3P11, NaP7, and NaP15[4] fünf weitere Natriumphosphide bekannt.[5]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Natriumphosphid kann durch Reaktion von Natrium und rotem Phosphor unter Argon gewonnen werden.[2]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Natriumphosphid ist ein außerordentlich luftempfindlicher roter Feststoff. Er besitzt eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194).[2] Diese besteht aus zwei Strukturelementen: Einer graphitähnlichen NaP-Schicht, die abwechselnd Na+ und P3− enthält und damit eine negative Gesamtladung hat und gewellten Schichten von Na+-Ionen, die die NaP-Schichten voneinander trennen.
Natriumphosphid reagiert mit Wasser unter exothermer Reaktion bei dem sich selbstentzündliche und hochtoxische Phosphine bilden.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Dale L. Perry: Handbook of Inorganic Compounds, Second Edition. CRC Press, 2011, ISBN 1-4398-1462-7, S. 488 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 960.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Inorganic Chemistry, Egon Wiberg, Arnold Frederick Holleman Elsevier 2001 ISBN 0-12-352651-5
- ↑ Martin Mayo, Kent J. Griffith, Chris J. Pickard, Andrew J. Morris: Ab Initio Study of Phosphorus Anodes for Lithium- and Sodium-Ion Batteries. In: Chemistry of Materials. Band 28, Nr. 7, 2016, S. 2011–2021, doi:10.1021/acs.chemmater.5b04208.