Nickel(II)-sulfit
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
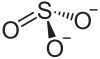
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Nickel(II)-sulfit | |||||||||||||||
| Andere Namen |
Nickelsulfit | |||||||||||||||
| Summenformel | NiSO3 | |||||||||||||||
| Kurzbeschreibung |
Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 138,74 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
2,04 g·cm−3 (Hexahydrat)[2] | |||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser (Hexahydrat)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Nickel(II)-sulfit ist eine anorganische chemische Verbindung des Nickels aus der Gruppe der Sulfite.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Nickel(II)-sulfit kann durch Reaktion von Nickelsalzlösungen wie Nickel(II)-bromid mit Sulfiten (z. B. Natriumsulfit oder Ammoniumsulfit) gewonnen werden.[3][5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Nickel(II)-sulfit ist ein grüner[6] Feststoff.[1] Aus wässrigen Lösungen kristallisiert das Hexahydrat aus, welches praktisch unlöslich in Wasser ist. Dieses wandelt sich 40, 55 und 85 °C in das Tri-, 2,5 und Dihydrat um.[3] Das Hexahydrat besitzt eine hexagonale Kristallstruktur mit der Raumgruppe R3 (Raumgruppen-Nr. 146).[2] Einige Quellen geben an, dass vom Hexahydrat zusätzlich auch eine tetragonale Modifikation[7] mit der Raumgruppe P4/nbm (Raumgruppen-Nr. 125) existiert.[6] Das 2,5-Hydrat hat eine Kristallstruktur mit der Raumgruppe P41212 (Raumgruppen-Nr. 92), das Dihydrat eine Kristallstruktur mit der Raumgruppe P21/n (Raumgruppen-Nr. 14, Stellung 2).[8]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu CAS-Nr. 7757-95-1 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Juli 2016. (JavaScript erforderlich)
- ↑ a b S. Baggio, L. N. Becka: A reinvestigation of the structure of nickel sulphite hexahydrate, NiSO3.6H2O. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 25, S. 1150, doi:10.1107/S0567740869003657.
- ↑ a b c M.R. Masson, H.D. Lutz, B. Engelen: Sulfites, Selenites & Tellurites. Elsevier, 2013, ISBN 978-1-4832-8643-3, S. 258 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Nickel(2+) sulphite im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Mark S. Cracolice, Ed Peters: Introductory Chemistry: An Active Learning Approach. Cengage Learning, 2015, ISBN 978-1-305-54501-4, S. 262-IA3 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b R. Blachnik: Taschenbuch für Chemiker und Physiker Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer-Verlag, 2013, ISBN 978-3-642-58842-6, S. 644 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ D. Nicholls: The Chemistry of Iron, Cobalt and Nickel Comprehensive Inorganic Chemistry. Elsevier, 2013, ISBN 978-1-4831-4643-0, S. 1131 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ H. D. Lutz, W. Eckers, B. Engelen: Zur Kenntnis der Sulfite und Sulfithydrate des Eisens und Nickels Röntgenographische, thermoanalytische, IR- und Raman-spektroskopische Untersuchungen. In: Zeitschrift für anorganische und allgemeine Chemie. 475, 1981, S. 165, doi:10.1002/zaac.19814750419.


