Nioboxidtrichlorid
| Kristallstruktur | |||||||
|---|---|---|---|---|---|---|---|
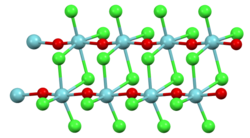
| |||||||
| _ Nb5+ _ O2− _ Cl− | |||||||
| Allgemeines | |||||||
| Name | Nioboxidtrichlorid | ||||||
| Andere Namen |
| ||||||
| Verhältnisformel | NbOCl3 | ||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 215,3 g·mol−1 | ||||||
| Aggregatzustand |
fest[1] | ||||||
| Dichte |
3,05 g·cm−3[2] | ||||||
| Löslichkeit | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Nioboxidtrichlorid ist eine anorganische chemische Verbindung des Niobs aus der Gruppe der Oxychloride.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Nioboxidtrichlorid kann durch Reaktion von Niob(V)-chlorid mit Sauerstoff bei 150 °C[1]
oder durch Hydrolyse gewonnen werden.
Ebenfalls möglich ist die Darstellung durch Reaktion von Niob(V)-oxid mit Thionylchlorid bei 200 °C.[1]
Oder durch Reaktion von Niob(V)-oxid und Niob(V)-chlorid:
Erhitztes Niob(V)-oxid in einem Strom aus Chlor bei 800–850 °C ergibt ebenfalls Nioboxidtrichlorid:
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Nioboxidtrichlorid liegt in Form von farblosen Nadeln vor. Oberhalb von 350 °C beginnt die Zersetzung in Niob(V)-chlorid und Niob(V)-oxid. Es ist, wie auch das entsprechende gelbe Nioboxidtribromid und schwarze Nioboxidtriiodid, sehr feuchtigkeitsempfindlich. In älterer Literatur wurde für die Verbindung eine tetragonale Kristallstruktur mit der Raumgruppe P42/mnm (Raumgruppen-Nr. 136), a = 1087 pm; c = 396 pm, angenommen[1], wobei neuere Untersuchungen eine nichtzentrosymmetrische Raumgruppe P421m (Nr. 113) (Wegfall der Spiegelebenen senkrecht zu den Doppelsträngen) ergaben.[4]
Neben diesem Oxychlorid des Niobs ist auch noch Nioboxiddichlorid bekannt.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band 3. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1457.
- ↑ a b c d Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 632 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Christian Kusterer: Reaktionen, Strukturen und Eigenschaften von Oxidhalogeniden und Halooxometallaten des Niobs und Wolframs. Dissertation, Universität Bonn, 2006. urn:nbn:de:hbz:5N-07896.




