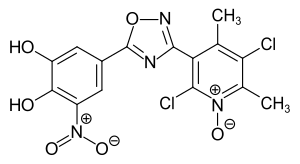
Opicapon
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Opicapon | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C15H10Cl2N4O6 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 413,2 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Opicapon ist ein Arzneistoff aus der Gruppe der COMT-Inhibitoren, der in der Zusatztherapie des Morbus Parkinson eingesetzt wird. Die europäische Zulassung erfolgte im Jahr 2016.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Opicapon ist ein nicht hygroskopisches gelbes Pulver mit schlechten Fließeigenschaften. Es ist in wässrigen Lösungen bei niedrigen pH-Werten unlöslich und bei höheren pH-Werten sehr schwer löslich. Opicapon kann in verschiedenen polymorphen Formen auftreten, welche sich in Kristallinität, Kristallwassergehalt und Solvatisierungsvermögen unterscheiden.[2]
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Opicapon ist als adjuvante Therapie (Zusatzbehandlung) bei Erwachsenen mit Morbus Parkinson zugelassen, die sogenannte „Off-Episoden“ erleiden und deren Symptome durch die Kombinationstherapie aus Levodopa und einem DOPA-Decarboxylasehemmer nicht stabilisiert werden können.[3][4]
Art und Dauer der Anwendung
[Bearbeiten | Quelltext bearbeiten]Die vom Arzt empfohlene Dosis wird einmal täglich als Hartkapsel peroral eingenommen. Bei schweren Leberfunktionsstörungen wird die Dosis durch den Arzt in der Regel reduziert.[4]
Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Gegenanzeigen sind die gleichzeitige Anwendung von nicht-selektiven Monoaminoxidase-Hemmern oder bei Phäochromozytom, Paragangliom oder anderen katecholaminsezernierenden Neoplasien in der Vorgeschichte.[4]
Besondere Patientengruppen
[Bearbeiten | Quelltext bearbeiten]Es liegen keine ausreichenden Daten über das Risiko bei der Anwendung durch schwangere oder stillende Frauen vor. Bei Tierversuchen ging Opicapon in die Muttermilch über.[4]
Sicherheit und Wirksamkeit bei pädiatrischen Patienten wurden nicht untersucht. Bei älteren Patienten und Patienten mit eingeschränkter Nierenfunktion ist keine Dosisanpassung erforderlich.[5]
Bei eingeschränkter Leberfunktion könnten Dosisanpassungen unter bestimmten Umständen durch den behandelnden Arzt in Betracht gezogen werden.[5]
Unerwünschte Wirkungen
[Bearbeiten | Quelltext bearbeiten]Die am häufigsten berichteten Nebenwirkungen waren Erkrankungen des Nervensystems. Dyskinesie war die am häufigsten berichtete unter der Behandlung aufgetretene unerwünschte Wirkung (17,7 %).[5]
Pharmakologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Opicapon ist ein peripherer, selektiver und reversibler Catechol-O-Methyltransferase (COMT)-Hemmer mit hoher Bindungsaffinität (sub-picomolarer Bereich), welche zu einer geringen Komplex-Dissoziationsratenkonstanten und langen Wirkdauer (> 24 Stunden) in vivo führt. In Gegenwart eines DOPA-Decarboxylasehemmers (DDCI) wird die COMT für Levodopa zum wichtigsten metabolisierenden Enzym, das dessen Umwandlung in 3-O-Methyldopa[6] im Gehirn und in der Peripherie katalysiert. Bei Patienten, die Levodopa und einen peripheren DDCI wie Carbidopa oder Benserazid einnehmen, erhöht Opicapon die Levodopa-Plasmaspiegel und verbessert dadurch das klinische Ansprechen auf Levodopa.[5]
Toxikologie
[Bearbeiten | Quelltext bearbeiten]Es liegen keine Daten zur LD50 von Opicapon vor. Es gibt kein bekanntes Gegenmittel für eine Überdosierung. Bei Überdosierung kann die Entfernung des Arzneimittels durch Magenspülung und/oder Inaktivierung durch Verabreichung von Aktivkohle erwogen werden.[4]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Ongentys (USA, EU, CH)
Literatur
[Bearbeiten | Quelltext bearbeiten]- Andrew J. Lees, Joaquim J. Ferreira, u. a.: Safety Profile of Opicapone in the Management of Parkinson’s Disease. In: Journal of Parkinson's disease. Band 9, Nr. 4, 2019, S. 733–740, doi:10.3233/JPD-191593, PMID 31498127 (englisch).
- Margherita Fabbri, Joaquim J. Ferreira, u. a.: Opicapone for the treatment of Parkinson's disease: A review of a new licensed medicine. In: Movement Disorders. Band 33, Nr. 10, 1. Oktober 2018, S. 1528–1539, doi:10.1002/mds.27475, PMID 30264443 (englisch).
- Ongentys – FULL PRESCRIBING INFORMATION. (PDF; 437 KB) In: fda.gov. April 2020 (englisch).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Ongentys. In: ema.europa.eu. European Medicines Agency
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Opicapone. In: pubchem.ncbi.nlm.nih.gov. PubChem – National Library of Medicine, 2023, abgerufen am 28. April 2023 (englisch).
- ↑ Ausschuss für Humanarzneimittel der europäischen Arzneimittelagentur: Assessment Report Ongentys, S. 9, 26. April 2016.
- ↑ Opicapone. In: drugbank.com. The Governors of the University of Alberta, 21. Februar 2021, abgerufen am 28. April 2023 (englisch).
- ↑ a b c d e Ongentys – FULL PRESCRIBING INFORMATION. (PDF; 437 KB) In: fda.gov. April 2020, abgerufen am 28. April 2023 (englisch).
- ↑ a b c d ANHANG I – ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS. (PDF) In: ema.europa.eu. European Medicines Agency, 13. Mai 2022, abgerufen am 28. April 2023.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 3-O-Methyldopa: CAS-Nr.: 300-48-1, PubChem: 9307, ChemSpider: 8948, Wikidata: Q15410220.