Morbus Osler
| Klassifikation nach ICD-10 | |
|---|---|
| I78.0 | Hereditäre hämorrhagische Teleangiektasie |
| ICD-10 online (WHO-Version 2019) | |

Morbus Osler oder Oslersche Krankheit, auch Morbus Osler-Weber-Rendu, ist eine angeborene Erkrankung, bei der es zu einer krankhaften Erweiterung von Blutgefäßen kommt. Diese sogenannten Teleangiektasien können überall auftreten, finden sich jedoch besonders in Nase (daher auch das Leitsymptom Nasenbluten), Mund, Gesicht und den Schleimhäuten des Magen-Darm-Traktes. Da die Gefäßerweiterungen sehr verletzlich sind, kann es leicht zu Einrissen und somit zur Blutung kommen.[2][3]
Synonyme sind: Osler-Syndrom; Morbus Osler-Rendu-Weber; hereditäre hämorrhagische Teleangiektasie (HHT oder Angiomatose), englisch ORW-Disease
Nicht zu verwechseln ist der Morbus Osler mit den Osler-Knötchen.
Die Erkrankung ist nach einer Beschreibung aus dem Jahre 1901 durch den kanadischen Arzt William Osler,[4] den französischen Arzt Henri Jules Louis Marie Rendu (1844–1902), Erstbeschreibung im Jahre 1896,[5] und einer Beschreibung von 1904 nach durch den englischen Arzt Frederick Parkes Weber (1863–1962)[6] benannt.[7]
Pathologie
[Bearbeiten | Quelltext bearbeiten]Unter anderem weiten sich kleinste Gefäße von Haut und Schleimhaut und sind anschließend als stecknadelkopf- bis reiskorngroße rote Flecken zu sehen. Besondere Bedeutung haben diese Teleangiektasien im Magen-Darm-Trakt, weil sie dort Ursache für häufig wiederkehrende (rezidivierende) Blutungen (hämorrhagische Diathesen) sein können. Es können jedoch auch bedeutend größere Gefäßerweiterungen auftreten. Diese entstehen besonders in der Lunge, dem Gehirn und der Leber. Die Veränderungen machen sich oft lange Zeit nicht bemerkbar, können jedoch z. B. durch Blutungen plötzlich sehr bedrohlich werden (s. u.). Die ersten Anzeichen der Erkrankung zeigen sich meist in der Pubertät mit Nasenbluten, bei wenigen Patienten jedoch auch ohne Nasenbluten und zum Teil viel später.
Verbreitung
[Bearbeiten | Quelltext bearbeiten]Die Häufigkeit wird mit zwischen 1:5.000 und 1:8.000 angegeben, die Vererbung erfolgt autosomal-dominant mit im Alter von 50 Jahren fast vollständiger Penetranz.[3] In Deutschland leiden rund 35.000 Menschen an M. Osler.
Einteilung und Ursachen
[Bearbeiten | Quelltext bearbeiten]Je nach zugrunde liegender Mutation werden derzeit folgende Formen unterschieden:
- HHT1, autosomal-dominant, Mutationen am ENG-Gen am Genlocus 9q34.11[8]
- HHT2, autosomal-dominant, Mutationen am ACVRL1-Gen an 12q13.13[9]
- HHT3, Mutationen an 5q31.3-q32[10]
- HHT4, autosomal-dominant, Mutationen am ACVRL1-Gen an 7p14[11]
- JPHT, mit juveniler Polyposis, autosomal-dominant, Mutationen am SMAD4-Gen an 18q21.1[12]
Die Gene ACVRL1 und ENG gehören zur Signalkette des Transforming growth factors und führen zu einer Störung des Gleichgewichtes der Angiogenese der Kapillaren mit überschießender Gefäßneubildung.[3] Die Gefäßneubildungen werden vorwiegend durch eine Rekrutierung von endothelialen Vorläuferzellen mit intussuszeptiver Angiogenese vorangetrieben.[13]
Möglicherweise gibt es auch Patienten, die genetisch Morbus-Osler-Patienten sind, die jedoch nie Anzeichen der Erkrankung zeigen.
Diagnostik
[Bearbeiten | Quelltext bearbeiten]Die Diagnose wird überwiegend klinisch gestellt, genetische Untersuchungen können jedoch entscheidend dazu beitragen.
Kriterien zur klinischen Diagnostik des Morbus Osler (HHT) (sog. Curaçao-Kriterien), erstellt vom medizinischen und wissenschaftlichen Beratungsgremium der amerikanischen Selbsthilfegruppe:
- Epistaxis – Nasenbluten (spontan und wiederholt)
- Teleangiektasien – Typische kleine Gefäßmissbildungen, mehrfach und an charakteristischen Stellen (Lippen, Mundhöhle, Finger, Nase)
- Viszerale Manifestationen – Beteiligung innerer Organe, besonders von Lunge, Leber, Hirn und Magen-Darm-Trakt (s. Text)
- Positive Familienanamnese – Wenigstens ein Verwandter ersten Grades, der nach diesen Kriterien betroffen ist.
Der Morbus Osler gilt als gesichert, wenn wenigstens drei dieser vier Kriterien erfüllt sind. Bei zwei erfüllten Kriterien geht man von einem Verdachtsfall aus. Auch wenn bei nur einem erfüllten Kriterium ein Morbus Osler unwahrscheinlich ist, ist dieser trotzdem möglich, z. B. betroffene Kinder, bei denen häufig nur der vierte Punkt erfüllt ist, während sich die anderen erst im Laufe des Lebens einstellen können. Hier ist häufig die genetische Diagnostik hilfreich.
Differentialdiagnose
[Bearbeiten | Quelltext bearbeiten]Abzugrenzen sind das CREST-Syndrom, der Lungenarterien-Hochdruck und die benigne hereditäre Teleangiektasie.[3]
Symptome und Behandlung
[Bearbeiten | Quelltext bearbeiten]Nasenbluten
[Bearbeiten | Quelltext bearbeiten]90 % aller Menschen mit Morbus Osler haben Nasenbluten, das meist bereits in der Pubertät auftritt und Ausmaße annehmen kann, die zu einer Einschränkung der Lebensqualität bis hin zur Arbeitsunfähigkeit führen können. Bei vielen Patienten kommt es zur Blutarmut (Anämie). Es kann erforderlich sein, Eisen oder Blut zuzuführen. Zur Vorbeugung werden Nasensalben verwendet, im Blutungsfall eine Nasentamponade. Operative Therapien sind die Laserlichtbehandlung der Gefäßerweiterung oder die Transplantation, bei der die erkrankte Nasenschleimhaut durch Haut aus anderen Gesichtsregionen (zum Beispiel von hinter dem Ohr) ersetzt wird. Eine Heilung auf Dauer ist bislang noch nicht möglich.
Lunge
[Bearbeiten | Quelltext bearbeiten]Ungefähr 5 bis 30 % aller Morbus-Osler-Patienten haben große Gefäßerweiterungen in den Lungen, sogenannte pulmonale arteriovenöse Malformationen (PAVM). Durch diese großen Gefäßkurzschlüsse können auch Gerinnsel und Bakterien passieren und so zu Schlaganfällen und Hirneiterungen (Abszessen) führen. Bei ärztlichen Eingriffen, insbesondere bei Zahnbehandlungen, kann es zur Einschwemmung von Bakterien in das Blut kommen. Deshalb wird empfohlen, dass alle Patienten, bei denen eine PAVM vorliegen könnte, vorher Antibiotika erhalten. Besonders während der Schwangerschaft können die abnormen Gefäße der Lunge deutlich an Größe zunehmen. Wenn der Kurzschluss zu groß wird, kann es zur Überlastung des Kreislaufs kommen. Lungenblutungen treten eher selten auf, können jedoch lebensbedrohlich sein. Bei Verdacht auf eine PAVM wird eine Computertomographie (CT) oder Kernspintomographie des Brustkorbs, eine Blutgasanalyse oder geeignete Ultraschalluntersuchungen durchgeführt.
Wenn erforderlich, lassen sich die erweiterten Gefäße durch das Einbringen von Metallspiralen oder kleinen Ballons verschließen (Embolisation). Selten sind jedoch auch große Operationen mit Öffnung des Brustkorbs angezeigt.
Gehirn
[Bearbeiten | Quelltext bearbeiten]Wie oben erläutert können bei Lungengefäßerweiterungen (PAVM) Gerinnsel und Bakterien die Lunge passieren und zu Schlaganfällen oder Hirnabszessen führen. Zusätzlich können auch cerebrale vaskuläre Malformationen (CVM, cerebral „zum Hirn gehörend“, vaskulär steht für Gefäß) auftreten. Auch bei den CVM können Blutungen auftreten, es muss jedoch nicht jede CVM behandelt werden. Es muss abgewogen werden, wie groß das Blutungsrisiko im Vergleich zum Behandlungsrisiko ist. Die Gefäßmissbildungen können durch Einbringen von Material über einen Katheter verschlossen (Embolisation) oder nach Öffnung der Schädeldecke operativ entfernt werden. Man schätzt die Häufigkeit der CVM auf 5 bis 20 %, deshalb empfiehlt die amerikanische Selbsthilfeorganisation den Morbus-Osler-Patienten, dass bei allen Patienten nach dem 12. Lebensjahr eine spezielle Kernspintomographie des Kopfes durchgeführt werden sollte. Bei Verdachtsmomenten (z. B. Kopfschmerzen oder Lähmungen) kann dies jedoch bereits früher sinnvoll sein.
Magen-Darm-Trakt
[Bearbeiten | Quelltext bearbeiten]Besonders ab dem 40. Lebensjahr kann es zu Magen- und Darmblutungen kommen. Diese Blutungen können geringgradig, jedoch auch sehr heftig sein. Der Stuhl kann bei starken Blutungen teerähnlich dunkel aussehen und „faul“ riechen oder mit rotem Stuhl durchmengt sein. Bei leichten Blutungen können diese Zeichen jedoch unbemerkt bleiben. Manchmal bringt erst die Abklärung einer Blutarmut, die vom Patienten meist als allgemeine Schwäche und Müdigkeit verspürt wird, den Arzt auf die richtige Spur. Zur Abklärung wird dann häufig eine Magen-Darm-Spiegelung durchgeführt. Finden sich dort wenige und geeignete Gefäßerweiterungen, so kann eine Behandlung mittels Laser, Unterspritzung oder elektrischer Verödung oft im gleichen Eingriff durchgeführt werden. Liegen viele Blutungsquellen vor und kommt es zu wiederholten Blutungen, so kann eine Therapie mit weiblichen Hormonen versucht werden. Aufgrund der möglichen Nebenwirkungen (unter anderem auf das Herz-Kreislauf-System und Brustbildung bei Männern) muss ein sorgfältiges Abwägen der Vor- und Nachteile erfolgen.
Leber
[Bearbeiten | Quelltext bearbeiten]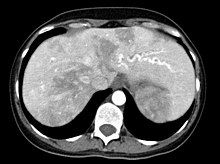
Auch in der Leber können Gefäßkurzschlüsse (Shunts) auftreten. Diese können zu einer Überlastung des Herzens führen, was von den Betroffenen häufig als Abgeschlagenheit und mangelnde körperliche Belastbarkeit, ähnlich wie bei der Blutarmut, empfunden wird. Die medikamentöse Verbesserung der Herzfunktion wird häufig als erster Schritt der Behandlung versucht. Es gibt eine Reihe eingreifender Behandlungen, insbesondere die Embolisation (s. o.) und die Lebertransplantation. Da die Nebenwirkungen gravierend sein können, ist hier ähnlich wie bei den CVM ein sorgfältiges Abwägen der Vor- und Nachteile erforderlich.
Literatur
[Bearbeiten | Quelltext bearbeiten]- emedicine medscape
- Ludwig Heilmeyer, Herbert Begemann: Blut und Blutkrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 376–449, hier: S. 445: Die Oslersche Krankheit (hereditäre, hämorrhagische Teleangiektasie oder Angiomatose).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ M. Sand, D. Sand, C. Thrandorf, V. Paech, P. Altmeyer, F. G. Bechara: Cutaneous lesions of the nose. In: Head & face medicine. Band 6, 2010, S. 7,ISSN 1746-160X. doi:10.1186/1746-160X-6-7. PMID 20525327. PMC 290354 (freier Volltext). (Review).
- ↑ Bernfried Leiber (Begründer): Die klinischen Syndrome. Syndrome, Sequenzen und Symptomenkomplexe. Hrsg.: G. Burg, J. Kunze, D. Pongratz, P. G. Scheurlen, A. Schinzel, J. Spranger. 7., völlig neu bearb. Auflage. Band 2: Symptome. Urban & Schwarzenberg, München u. a. 1990, ISBN 3-541-01727-9.
- ↑ a b c d Eintrag zu Hereditäre hämorrhagische Teleangiektasie. In: Orphanet (Datenbank für seltene Krankheiten)
- ↑ W. B. Osler: On a family form of recurring epistaxis, associated with multiple telangiectases of the skin and mucous membranes. In: The Johns Hopkins Hospital Bulletin, 1901, Bd. 12:S. 333–337.
- ↑ M. Rendu: Epistaxis répétés chez un sujet porteur de petits angiomes cutanés et muqueux. In: Lancette française: gazette des hôpitaux civils et militaires, Paris, 1896, Bd. 69: S. 1322–1323.
- ↑ F. P. Weber: A note on cutaneous telangiectases and their etiology. Comparison with the etiology of haemorrhoids and ordinary varicose veins. In: Edinburgh Medical Journal, 1904: S. 346–349.
- ↑ Who named it
- ↑ Telangiectasia, hereditary hemorrhagic, type 1. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ Telangiectasia, hereditary hemorrhagic, type 2. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ Telangiectasia, hereditary hemorrhagic, type 3. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ Telangiectasia, hereditary hemorrhagic, type 4. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ Juvenile polyposis/hereditary hemorrhagic telangiectasia syndrome. In: Online Mendelian Inheritance in Man. (englisch)
- ↑ Maximilian Ackermann, Steven J Mentzer, Wilfried Roth, Urban Geisthoff, Erich Stoelben: Pulmonary microvascular architecture in hereditary haemorrhagic telangiectasia. In: Thorax. Band 72, Nr. 9, September 2017, ISSN 0040-6376, S. 861–863, doi:10.1136/thoraxjnl-2016-209299 (bmj.com [abgerufen am 8. Februar 2020]).
Weblinks
[Bearbeiten | Quelltext bearbeiten]- morbus-osler.de - Homepage der Morbus-Osler-Selbsthilfe e. V.
- Morbus Osler - was ist das
- Merkblatt Morbus Rendu-Osler-Weber der Morbus-Osler-Selbsthilfe