Pantolacton
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
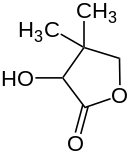
| |||||||||||||||||||
| Strukturformel von Pantolacton ohne Angabe zur Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Pantolacton | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H10O3 | ||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 130,14 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Dichte |
1,25 g·cm−3[2] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Pantolacton ist eine chemische Verbindung aus der Gruppe der substituierten Lactone.
Isomere
[Bearbeiten | Quelltext bearbeiten]Pantolacton enthält ein Stereozentrum, ist also chiral und kommt in zwei enantiomeren Formen, (R)-Pantolacton und (S)-Pantolacton, vor. Racemisches Pantolacton [Synonym: (RS)-Pantolacton] ist ein 1:1-Gemisch aus dem (R)- und dem (S)-Enantiomer.
| Isomere von Pantolacton | ||
| Name | (S)-Pantolacton | (R)-Pantolacton |
| Andere Namen | (+)-Pantolacton | (−)-Pantolacton |
| Strukturformel | 
|

|
| CAS-Nummer | 5405-40-3 | 599-04-2 |
| 79-50-5 (Racemat) | ||
| EG-Nummer | 626-470-2 | 209-963-3 |
| 201-210-7 (Racemat) | ||
| ECHA-Infocard | 100.149.096 | 100.009.059 |
| 100.001.101 (Racemat) | ||
| PubChem | 736053 | 439368 |
| 989 (Racemat) | ||
| Wikidata | Q117089368 | Q27102042 |
| Q22829045 (Racemat) | ||
Vorkommen
[Bearbeiten | Quelltext bearbeiten]Pantolacton kommt in Wein und Sherryaroma vor.[2]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten](R)-Pantolacton wird durch Abbau von Pantothensäure oder durch enantioselektive Reduktion des entsprechenden Oxolactons erhalten. Beide Stereoisomere lassen sich durch Racemattrennung mit (R)- und (S)-Phenylethanamin getrennt isolieren.[2][6][7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Pantolacton ist ein farbloser Feststoff, der löslich in Wasser ist.[1] Die Verbindung ist leicht biologisch abbaubar. Die Hydrolyse-Halbwertszeit für DL-Lacton beträgt etwa ein Jahr bei einem pH-Wert von 4, 30 Tage bei einem pH-Wert von 7 und etwa 12 Tage bei einem pH-Wert von 9 (25 °C).[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Neben der Anwendung als chiraler Hilfsstoff für diastereoselektive Diels-Alder-Reaktionen dient (R)-Pantolacton als Synthesebaustein aus dem sogenannten „chiral pool“ zum Beispiel für die Synthese von Bryostatin und dem antibiotisch wirkenden Elfamycin.[2] Es wird in der Kosmetikindustrie auch als Feuchthaltemittel eingesetzt.[8]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Datenblatt DL-α-Hydroxy-β,β-dimethyl-γ-butyrolactone, purum, ≥97.0% (T) bei Sigma-Aldrich, abgerufen am 19. Oktober 2019 (PDF).
- ↑ a b c d e f Eintrag zu Pantolacton. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Oktober 2019.
- ↑ Eintrag zu CAS-Nr. 599-04-2 in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. April 2024. (JavaScript erforderlich)
- ↑ a b c OECD: OECD SIDS DL-LACTONE, abgerufen am 3. April 2024
- ↑ Eintrag zu DL-Pantolactone bei TCI Europe, abgerufen am 3. April 2024.
- ↑ Joachim Paust, Sigberg Pfohl, Werner Reif, Wolfram Schmidt: Racematspaltung von Pantolacton mit neuen chiralen Aminen. In: Justus Liebigs Annalen der Chemie. 1978, 1978, S. 1024, doi:10.1002/jlac.197819780612.
- ↑ Paul Präve: Handbuch der Biotechnologie. Oldenbourg Industrieverlag, 1994, ISBN 978-3-8356-6223-0, S. 719 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ dr-pfleger.de: INCI-Lexikon - Service für Patientinnen und Patienten - Produkte - dr-pfleger.de ( vom 19. Oktober 2019 im Internet Archive), abgerufen am 19. Oktober 2019