Paramyxoviridae
| Paramyxoviridae | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

Masernvirus in der Dünnschicht-TEM | ||||||||||||||||
| Systematik | ||||||||||||||||
| ||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||
| ||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||
| Paramyxoviridae | ||||||||||||||||
| Links | ||||||||||||||||
|
Die Familie Paramyxoviridae umfasst behüllte Viren mit einer einzelsträngigen, linearen RNA mit negativer Polarität als Genom. Die Familie Paramyxoviridae entstand aus der veralteten taxonomischen Gruppe der Myxoviren (gr. myxa: Schleim) durch Abgrenzung (gr. para: neben) von den „echten Myxoviren“ (Orthomyxoviridae). Zu den Paramyxoviridae gehören Virusspezies, die das respiratorische System selbst betreffen oder von ihm aus ihren Ausgang nehmen (Spezies der ehem. Unterfamilie Paramyxovirinae). Die Paramyxoviridae werden nicht durch Vektoren und fast ausschließlich durch Tröpfcheninfektion übertragen. Dies sind bei Säugetieren und Vögeln weit verbreitete und wichtige Erkrankungen wie z. B. die Staupe und die Newcastle-Krankheit, beim Menschen sind es Infektionen wie Masern, Mumps und Parainfluenza.
Morphologie
[Bearbeiten | Quelltext bearbeiten]Virionen
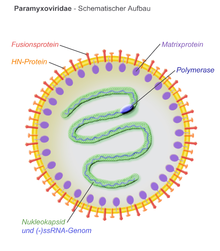
[Bearbeiten | Quelltext bearbeiten]Die Virionen der Paramyxoviridae haben meist eine runde Gestalt und sind etwa 150 nm im Durchmesser groß. Auch unregelmäßig geformte oder fadenförmige (filamentöse) Formen sind beschrieben.
Virushülle
[Bearbeiten | Quelltext bearbeiten]Die Virushülle stammt direkt von der äußeren Zellmembran (ähnlich wie bei Retroviren) und umgibt ein helikales Kapsid. In die Virushülle sind 2 bis 3 transmembranäre Glykoproteine eingelagert. Mehrere gleiche Membranproteine lagern sich zu Oligomeren zusammen und bilden sog. Spikes von 8–12 nm Länge und einem Abstand von 7–10 nm (je nach Gattung). Diese bilden nach außen ein Fusionsprotein zum Eindringen in die Zellmembran und ein Protein zur Kontaktaufnahme (Attachment) an die Zelle. Ein nicht-glykosyliertes Membranprotein befindet sich stets bei den Paramyxoviridae mit seinem Hauptanteil nach innen gerichtet und kleidet so die Hülle von innen aus (sog. Matrixproteine).
Das Kapsid (ein Ribonukleokapsid) ist 13 bis 18 nm dick und kann je nach Länge des verpackten RNA-Stranges bei manchen Spezies bis 1000 nm lang sein. Obwohl man aufgrund von Verpackungsfehlern während der Virusvermehrung auch mehrfache Kapside in einer Hülle finden kann, ist doch überwiegend nur ein Kapsid und ein RNA-Strang pro Virion vorhanden. Im Virion befindet sich auch stets mindestens ein Molekül der viralen RNA-Polymerase und manchmal Teilstücke einer komplementären (+)ssRNA.
Genom
[Bearbeiten | Quelltext bearbeiten]Das virale Genom besteht aus einer einzelsträngigen RNA mit negativer Polarität. Die Länge der RNA ist ungewöhnlich konstant und innerhalb der Gattungen sehr ähnlich. Sie beträgt etwa 13 kB (Genus Metapneumovirus) bis 18 kB (Genus Henipavirus), bei den meisten Paramyxoviren meist um 15 kB. Betrachtet man die Länge einzelner Mitglieder der Unterfamilie Paramyxovirinae genauer, so folgt diese einer bei Viren ungewöhnlichen Gesetzmäßigkeit, der Teilbarkeit durch die Zahl 6: z. B. Mumpsvirus 15.384 nt, Newcastle-Disease-Virus 15.156 nt. Diese Vielfachen der Zahl 6 sind in einem besonderen Mechanismus der RNA-Vermehrung bei diesen Viren begründet.[3]
Biologische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Paramyxoviridae können Säugetiere und Vögel infizieren. Es gibt noch nicht klassifizierte, jedoch den Paramyxoviren nahestehende Viren bei Fischen (Lachse der Gattung Oncorhynchus) und Reptilien.[4] Bei der Vermehrung lösen Paramyxoviridae die Zelle auf und sind damit cytolytisch. Die einzelnen Virusspezies sind sehr eng an ihren jeweiligen Wirt angepasst und können daher kaum von einer Wirtsspezies auf eine andere übertragen werden. Üblicherweise verursachen Paramyxoviridae eine akute und selbstlimitierende Infektion, die von einem nicht beeinträchtigten Immunsystem des Wirtes wieder eliminiert wird. Eine chronische oder persistierende Infektion ist als Sonderfall nur beim Masernvirus (als Subakute sklerosierende Panenzephalitis) und beim Caninen Staupevirus (bei Hunden Erregerpersistenz und Ausscheidung über Monate) beschrieben.
Systematik
[Bearbeiten | Quelltext bearbeiten]
Innere Systematik nach ICTV, Stand November 2018 (auszugsweise):[6]
- Familie Paramyxoviridae (zu humanpathogenen Paramyxoviren siehe auch Parainfluenza)
- Unterfamilie Avulavirinae
- Gattung Metaavulavirus
- Spezies Avian metaavulavirus 2 (= Yucaipa virus), 5, 6, 7, 8, 10, 11, 14, 15, 20 (ehemals Avian avulavirus ... bzw. Avian paramyxovirus, APMV)
- Gattung Orthoavulavirus
- Spezies Avian orthoavulavirus 1 (=Newcastle disease virus, NDV), 9, 12, 13, 16, 17, 18, 19, 21 (ehemals Avian avulavirus ... bzw. Avian paramyxovirus, APMV)
- Gattung Paraavulavirus
- Spezies Avian paraavulavirus 3, 4 (ehemals Avian avulavirus ... bzw. Avian paramyxovirus, APMV) – Paramyxovirus-3-Infektion
- Unterfamilie Metaparamyxovirinae
- Gattung Synodonvirus
- Unterfamilie Orthoparamyxovirinae
- Gattung Aquaparamyxovirus
- Spezies Salmon aquaparamyxovirus (alias Atlantic salmon paramyxovirus, AsaPV)
- Gattung Ferlavirus
- Spezies Reptilian ferlavirus (Reptilien-Ferlavirus)
- Gattung Henipavirus
- Spezies Cedar henipavirus (Zedern-Virus, CedV)
- Spezies Hendra henipavirus (Hendra-Virus, HeV, früher Equines Morbillivirus) – Pneumonie; Enzephalitis
- Spezies Mojiang henipavirus (MojV)
- Spezies Nipah henipavirus (Nipah-Virus, NiV) – Pneumonie; Enzephalitis
- Gattung Jeilongvirus
- Gattung Morbillivirus
- Spezies Canine morbillivirus (alias Canine distemper virus, CDV)
- Spezies Measles morbillivirus (Masernvirus, MeV) – Masern
- Spezies Rinderpest morbillivirus (Rinderpestvirus, RPV)
- Spezies Small ruminant morbillivirus (alias Tupaia Paramyxovirus, TupPV)
- Gattung Narmovirus
- Gattung Respirovirus[9]
- Spezies Bovine respirovirus 3 (alias Bovine parainfluenza virus 3, bPIV3)
- Spezies Human respirovirus 1 und 3 (Humanes Respirovirus 1 und 3, HPIV1 und …3) – Erkältung, Parainfluenza
- Spezies Murine respirovirus (alias Murines Parainfluenzavirus 1, mit Sendai-Virus)
- Gattung Salemvirus
- Unterfamilie Rubulavirinae (ehem. Gattung Rubulavirus)
- Gattung Orthorubulavirus
- Spezies Human orthorubulavirus 2 (früher Human respirovirus 2, Humanes Parainfluenzavirus 2, HPIV2) – Erkältung, Parainfluenza
- Spezies Human orthorubulavirus 4 (früher Human respirovirus 4, Humanes Parainfluenzavirus 4, HPIV4) – Erkältung, Parainfluenza
- Spezies Mammalian orthorubulavirus 5
- Spezies Mammalian orthorubulavirus 6
- Spezies Mapuera orthorubulavirus (früher Mapuera rubulavirus, de. Mapuera-Virus, MprPV)
- Spezies Mumps orthorubulavirus (früher Mumps rubulavirus, de. Mumpsvirus, MuV) – Mumps
- Spezies Porcine orthorubulavirus (früher Porcine respirovirus 1, de. Schweine-Rubulavirus, PorPV)
- Spezies Simian orthorubulavirus
- Gattung Pararubulavirus
- Spezies Achimota pararubulavirus 1
- Spezies Achimota pararubulavirus 2
- Spezies Hervey pararubulavirus
- Spezies Menangle pararubulavirus (früher Menangle rubulavirus, de. Menangle-Virus, MenPV)
- Spezies Sosuga pararubulavirus
- Spezies Teviot pararubulavirus
- Spezies Tioman pararubulavirus (früher Tioman rubulavirus, Tioman paramyxovirus, de. Tioman-Virus, TioPV)
- Spezies Tuhoko pararubulavirus 1
- Spezies Tuhoko pararubulavirus 2
- Spezies Tuhoko pararubulavirus 3
- ohne zugewiesene Unterfamilie
- Gattung Cynoglossusvirus
- Gattung Hoplichthysvirus
- Gattung Scoliodonvirus
- Aus der zweiten ursprünglichen Unterfamilie Pneumovirinae innerhalb der Familie entstand die eigenständige Virusfamilie Pneumoviridae.
Literatur
[Bearbeiten | Quelltext bearbeiten]- C.M. Fauquet, M.A. Mayo et al.: Eighth Report of the International Committee on Taxonomy of Viruses, London, San Diego 2005
- David M. Knipe, Peter M. Howley et al. (eds.): Fields´ Virology, 4. Auflage, Philadelphia 2001
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Paramyxoviridae: Genera und Spezies (NCBI)
- Bildergalerie der Familie Paramyxoviridae (Big Picture Book of Viruses, via WebArchiv vom 23. Januar 2008)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b ICTV: ICTV Taxonomy history: Akabane orthobunyavirus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- ↑ ICTV Master Species List 2018b v1 MSL #34, Feb. 2019
- ↑ D. Kolakofsky, T. Pelet et al.: Paramyxovirus RNA synthesis and the requirement for hexamer genome length: the rule of six revisited. Journal of Virology (1998) 197, 1–11
- ↑ J. Franke, S. Essbauer, W. Ahne, S. Blahak: Identification and molecular characterization of 18 paramyxoviruses isolated from snakes. Virus Research (2001) 28;80: 67–74
- ↑ G. A. Marsh, C. de Jong, J. A. Barr, M. Tachedjian, C. Smith, D. Middleton, M. Yu, S. Todd, A. J. Foord, V. Haring, J. Payne, R. Robinson, I. Broz, G. Crameri, H. E. Field, L. F. Wang: Cedar virus: a novel Henipavirus isolated from Australian bats. In: PLoS Pathogens. 8. Jahrgang, Nr. 8, 2012, S. e1002836, doi:10.1371/journal.ppat.1002836, PMID 22879820, PMC 3410871 (freier Volltext) – (englisch).
- ↑ ICTV: Master Species List 2018a v1 ( des vom 14. März 2019 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis., MSL #33 vom Herbst 2018.
- ↑
Emily DeRuyter, Kuttichantran Subramaniam, Samantha M. Wisely, J. Glenn Morris and John A. Lednicky: A Novel Jeilongvirus from Florida, USA, Has a Broad Host Cell Tropism Including Human and Non-Human Primate Cells. In: MDPI: Pathogens, Band 13, Nr. 10, Section Viral Pathogens, 26. September 2024, S. 831; doi:10.3390/pathogens13100831 (englisch). Dazu:
- Black Cat Brings More Than Treats: Unveiling a New Virus This Halloween. Auf: SciTechDaily vom 30. Oktober 2024. Quelle: University of Florida.
- Melanie Rannow: Neues Virus entdeckt – dank einer Katze. Auf: T-Online vom 31. Oktober 2024.
- ↑ NCBI Taxonomy Browser: Gainesville rodent jeilong virus 1 (species).
- ↑ SIB: Respirovirus, auf: ViralZone