Phloroglucintrioxim
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
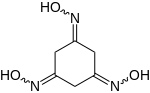
| |||||||||||||
| (E,Z)-Isomerengemisch | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Phloroglucintrioxim | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C6H9N3O3 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 171,16 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Phloroglucintrioxim ist ein Oxim, das sich von der Ketoform des Phloroglucins ableitet.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Phloroglucintrioxim spielte eine Rolle bei der Untersuchung der Eigenschaften von Phloroglucin (1,3,5-Trihydroxybenzol). 1886 wurde entdeckt, dass es durch Umsetzung mit Hydroxylamin Phloroglucintrioxim bildet. Da diese Reaktion typisch für Ketone ist, konnte aus der Beobachtung abgeleitet werden, dass Phlorglucin zum Teil als Triketon vorliegt.[2][3]
Herstellung
[Bearbeiten | Quelltext bearbeiten]Phloroglucintrioxim kann durch Umsetzung von Phloroglucin mit Hydroxylamin erhalten werden.[3][4] Dabei entsteht ein Gemisch aus den zwei Isomeren. Das asymmetrische Isomer macht dabei etwa 95 % des Gemisches aus.[4]
Reaktionen und Verwendung
[Bearbeiten | Quelltext bearbeiten]Phloroglucin wird als Edukt für die Herstellung anderer Verbindungen verwendet. So kann es zu Trinitrosobenzol und Trinitrobenzol[4][5] oxidiert werden und zu Triaminobenzol[S 1] und Triaminocyclohexan[S 2] reduziert[6][7] werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Adolf Baeyer: Ueber das Trioxim des Phloroglucins. In: Berichte der deutschen chemischen Gesellschaft. Band 19, Nr. 1, 1886, S. 159–163, doi:10.1002/cber.18860190145.
- ↑ a b Martin Lohrie, Wilhelm Knoche: Dissociation and keto-enol tautomerism of phloroglucinol and its anions in aqueous solution. In: Journal of the American Chemical Society. Band 115, Nr. 3, Februar 1993, S. 919–924, doi:10.1021/ja00056a016.
- ↑ a b c Jeffrey C. Bottaro, Ripudaman Malhotra, Allen Dodge: A Facile Two-Step Synthesis of 1,3,5-Trinitrobenzene. In: Synthesis. Nr. 4, 2004, S. 499–500, doi:10.1055/s-2004-815958.
- ↑ O. R. Klyuchnikov, F. G. Khairutdinov: Synthesis of 1,3,5-trinitrosobenzene. In: Russian Chemical Bulletin. Band 53, Nr. 5, Mai 2004, S. 1133–1134, doi:10.1023/B:RUCB.0000041314.42029.a7.
- ↑ Isamu Arai, Yuji Sei, Ichiro Muramatsu: Preparation of 1,3,5-triaminobenzene by reduction of phloroglucinol trioxime. In: The Journal of Organic Chemistry. Band 46, Nr. 22, Oktober 1981, S. 4597–4599, doi:10.1021/jo00335a066.
- ↑ J.H. Grimes, A.J. Huggard, S.P. Wilford: The stabilities of the alkaline earth chelates of some polyaminopolycarboxylic acids. In: Journal of Inorganic and Nuclear Chemistry. Band 25, Nr. 10, Oktober 1963, S. 1225–1238, doi:10.1016/0022-1902(63)80386-3.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Triaminobenzol: CAS-Nr.: 108-72-5, EG-Nr.: 203-610-7, ECHA-InfoCard: 100.003.283, PubChem: 66952, ChemSpider: 60311, Wikidata: Q27117974.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Triaminocyclohexan: CAS-Nr.: 26150-46-9, PubChem: 427712, Wikidata: Q64940745.

