Phoron
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Phoron | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C9H14O | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 138,20 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||
| Dichte |
0,88 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
197 °C[1] | |||||||||||||||
| Löslichkeit |
schwer löslich in Wasser[1] | |||||||||||||||
| Brechungsindex |
1,497 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Phoron ist der Trivialname eines Produktes der Kondensation von Aceton. Der systematische Name lautet 2,6-Dimethylhepta-2,5-dien-4-on. Der englische Trivialname (phorone) soll ein Kunstwort aus camphor und acetone sein.[4]
Die Verbindung ist einer der ältesten Vertreter der Verbindungsklasse der sogenannten α,β-ungesättigten Ketone, die später konjugierte Enone genannt wurden. Phoron hat eine gelbe Farbe und spielte deshalb historisch eine Rolle in den Theorien über Konstitution und Farbe.
Darstellung und Gewinnung
[Bearbeiten | Quelltext bearbeiten]Es wurde 1849 von Gerhardt und Liès-Bodart durch Destillation von camphersaurem Kalk erhalten.[5]
Phoron bildet sich bei der Reaktion von Aceton mit trockenem Chlorwasserstoff, wobei als Hauptprodukt Mesityloxid entsteht. Dieses kondensiert mit Aceton zum Phoron (doppelte Kondensation des Acetons).[4]
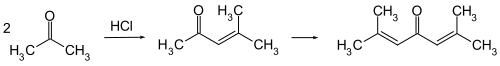
Bei der Reaktion handelt es sich um eine einfache Aldol-Kondensation zum Mesityloxid und um eine doppelte Aldol-Kondensation zum Phoron. Das gebildete Gemisch aus Mesityloxid, Phoron und höhermolekularen Komponenten muss destillativ aufgereinigt werden.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Phoron bildet gelblichgrüne Kristalle, die einen geranienähnlichem Geruch besitzen.[6] Es besitzt mit 28 °C einen niedrigen Schmelzpunkt. Unter Normaldruck siedet die Verbindung bei 197 °C.[7] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,1950, B = 2259,288 und C = −35,106 im Temperaturbereich von 315 bis 470 K.[8] Phoron ist in Ethanol und Ether gut und in Wasser nur wenig löslich.[6] Baeyer beschrieb es als "an der Luft recht beständig".[2]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Die Verbindung wird als Lösemittel für Nitrocellulose und Lacke verwendet.[6] Phoron kann in der Lebensmittelanalytik zur Bestimmung von Thiolen genutzt werden.[6] Es ist in der organischen Synthese ein vielseitiger Ausgangsstoff z. B. für die Herstellung von 2,2,6,6-Tetramethyl-4-piperidon, von 2,2,6,6-Tetramethylpiperidin oder des stabilen freien Radikals TEMPO (2,2,6,6-Tetramethylpiperidinyloxyl).[6] Weiterhin ist es ein Zwischenprodukt bei Michael-Additionen oder in Heterocyclen-Synthesen.[6]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h Eintrag zu Phoron in der GESTIS-Stoffdatenbank des IFA, abgerufen am 17. Mai 2024. (JavaScript erforderlich)
- ↑ a b Adolf von Baeyer: Synthese des Neurins. In: Annalen der Chemie und Pharmacie. 140, 1866, S. 306–313, doi:10.1002/jlac.18661400308. (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ Datenblatt 2,6-Dimethyl-2,5-heptadien-4-one, 95% bei Sigma-Aldrich, abgerufen am 17. Mai 2024 (PDF).
- ↑ a b L. F. Fieser und M. Fieser, Lehrbuch der Organischen Chemie, übersetzt und bearbeitet von H. R. Hensel, S. 222, Verlag Chemie, Weinheim, 1954.
- ↑ August Kekulé: Lehrbuch der organischen chemie … Ferdinand Enke, 1866, S. 463 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c d e f Eintrag zu Phoron. In: Römpp Online. Georg Thieme Verlag, abgerufen am 14. Juni 2014.
- ↑ CRC Handbook of Data on Organic Compounds, 2nd Edition, Weast,R.C and Grasselli, J.G., ed(s)., CRC Press, Inc., Boca Raton, FL, 1989, 1.
- ↑ Stull, D.R.: Vapor Pressure of Pure Substances Organic Compounds in Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Beyer-Walter: Lehrbuch der Organischen Chemie, 21. Auflage, S. 223, Hirzel, Stuttgart, 1988.
