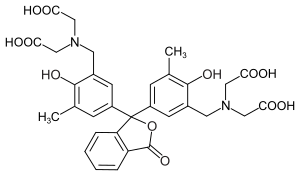
Metallphthalein
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Metallphthalein | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C32H32N2O12 | ||||||||||||||||||
| Kurzbeschreibung |
beiges, geruchloses, kristallines Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 636,62 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Metallphthalein ist ein Triphenylmethanfarbstoff und gehört zur Gruppe der Phthaleine. Das analoge Sulfonphthalein ist das Xylenolorange. Es wird als Indikator in der Komplexometrie eingesetzt.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Metallphthalein enthält einen Lactonring, vier Carboxy-, zwei Amino- und zwei Hydroxygruppen, die jeweils protoniert bzw. deprotoniert werden können. Weiters kann im stark sauren bzw. basischen Milieu auch der Lactonring gespalten werden. Bei pH ≈ 12–13 liegt Metallphthalein in einer rosafarbenen Form vor. In dieser Form bildet es mit einigen zweiwertigen Metallionen einen schwachen violettgefärbten Komplex, der durch Zugabe eines stärkeren Komplexbildners wie zum Beispiel EDTA wieder zerstört wird.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Metallphthalein wird, neben Eriochromschwarz T, in der Komplexometrie zur Bestimmung von Ba2+, Ca2+, Cd2+, Mg2+ und Sr2+ als Indikator eingesetzt.[4][5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Phthaleinpurpur bei Merck, abgerufen am 25. Dezember 2019.
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 897.
- ↑ M. Hübel, Ciba Geigy et al.: Laborpraxis. Band 4, 5. Auflage, Birkhäuser-Verlag, Basel 1996, S. 123 (eingeschränkte Vorschau in der Google-Buchsuche)
- ↑ Eintrag zu Metallphthalein. In: Römpp Online. Georg Thieme Verlag, abgerufen am 25. September 2017.
- ↑ aprentas (Hrsg.): Laborpraxis. 6. Auflage. Band 4: Analytische Methoden. Springer-Verlag, 2017, ISBN 978-3-0348-0972-6, S. 29 (eingeschränkte Vorschau in der Google-Buchsuche).