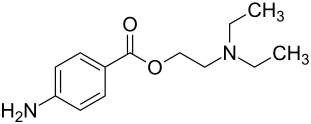
Procain
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Procain | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C13H20N2O2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Blockade spannungsabhängiger Natriumkanäle[1] | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||||||||
| pKS-Wert |
8,05 (15 °C)[3] | |||||||||||||||||||||
| Löslichkeit |
Wasser: 9,45 g·l−1 (30 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Procain (auch Prokain) ist ein Lokalanästhetikum vom Ester-Typ, das zuerst in der Zahnmedizin, danach auch für Verfahren der Regionalanästhesie in der Chirurgie eingesetzt wurde. Es ist hauptsächlich unter dem Markennamen Novocain (auch „Novokain“[5]) oder Novocaine bekannt.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Procain wurde 1904 von den deutschen Chemikern Alfred Einhorn und Emil Julius Uhlfelder synthetisiert und patentiert[6] und im Jahre 1905 in den Handel gebracht.[7] Handelsname für das Produkt wurde Novocain (von lateinisch novus „neu“, und -cain abgeleitet von Cocain).[8][9] Im Jahr 1909 wurde durch August Bier erstmals die intravenöse Regionalanästhesie mit 0,5-prozentiger Procainlösung eingeführt.[10]
Anwendung
[Bearbeiten | Quelltext bearbeiten]Vor der Entdeckung des Procains war Cocain das meistverwendete Lokalanästhetikum. Procain hat keine euphorisierende Wirkung wie Cocain und fällt daher nicht unter den Geltungsbereich der Betäubungsmittelgesetze und -verordnungen. Procain wird heute für die Lokalanästhesie nur noch selten verwendet, da hierfür wirksamere, weit tiefer eindringfähige Stoffe, wie etwa Lidocain, zur Verfügung stehen. Bei Patienten mit einem Melkersson-Rosenthal-Syndrom können allergische und toxische Reaktionen des Nervensystems auftreten.
Wegen seiner geringen parasympatholytischen, antientzündlichen und perfusionssteigernden Wirkung wird Procain in der Neuraltherapie verwendet, einer Behandlungsart aus der Alternativmedizin.
Im Kombinationspräparat Otalgan zur Behandlung der akuten Mittelohrentzündung und von Ohrenschmerzen ist unter anderem Procain enthalten.[11]
Procain kann das Enzym DNA-Methylase hemmen.[12] Diese Eigenschaft könnte genutzt werden, um paragenetische Schäden der Genexpression rückgängig zu machen. Dies ist vor allem bei Schäden an sogenannten Tumorsuppressorgenen wie p53 interessant.
Wirkmechanismus
[Bearbeiten | Quelltext bearbeiten]Durch den Einsatz von Procain werden spannungsabhängige Natriumkanäle blockiert und somit der schnelle Natriumeinstrom (der für eine Depolarisation an der Zellmembran von Axonen zuständig ist) verhindert. Dadurch wird eine Erregungsweiterleitung unterbunden. In geringerem Maße werden auch andere Ionenkanäle wie z. B. Kaliumkanäle blockiert. Wegen der Herabsetzung der Erregbarkeit des Herzmuskels führte R. Mautz das Procain 1936 als Mittel zur Prophylaxe von Kammerflimmern bei herzchirurgischen Eingriffen in die klinische Praxis ein.[13] Damit das Lokalanästhetikum am Ionenkanal wirken kann, muss es in seiner unprotonierten Form in die Zelle eindringen und dort in protonierter Wirkform am Natriumkanal angreifen. Der Einsatz in entzündlichem Gewebe ist erschwert, da dort das pH-Gleichgewicht auf die Seite der protonierten Form verschoben ist und das geladene Molekül die Zellmembran nicht penetriert.[1]
Abbau
[Bearbeiten | Quelltext bearbeiten]Procain wird im Blut und in den Geweben durch die Pseudocholinesterase in Paraaminobenzoesäure (PABA) und Diethylaminoethanol verstoffwechselt.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Es sind zwei verschiedene Methoden zur Procain-Synthese in der Literatur beschrieben.[14] Die basenkatalysierte Umesterung[15] von 4-Aminobenzoesäureethylester mit 2-Diethylaminoethanol liefert direkt Procain:

Alternativ kann Procain aus 4-Nitrobenzoesäure hergestellt werden. Dazu wird 4-Nitrobenzoesäure mit Thionylchlorid in 4-Nitrobenzoesäurechlorid umgewandelt. Dann wird mit 2-Diethylaminoethanol verestert und die Nitrogruppe mit Wasserstoff/Raney-Nickel zur Aminogruppe reduziert.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Mutschler, Geisslinger, Kroemer, Schäfer-Korting, Mutschler Arzneimittelwirkungen, 8. Auflage, 2001, ISBN 3-8047-1763-2, S. 267 ff.
- ↑ a b The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage, 2006, S. 1333–1334, ISBN 978-0-911910-00-1.
- ↑ a b c Eintrag zu Procaine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b Datenblatt Procaine hydrochloride bei Sigma-Aldrich, abgerufen am 22. April 2011 (PDF).
- ↑ www.wissen.de.
- ↑ Patent DE170587C: Verfahren zur Darstellung von o- und m-Aminobenoësäurealkaminestern. Angemeldet am 16. April 1905, veröffentlicht am 3. Mai 1906, Anmelder: Farbwerke vorm. Meister Lucius & Brüning.
- ↑ S. Isomura, T. Z. Hoffman, P. Wirsching, K. D. Janda: Synthesis, properties, and reactivity of cocaine benzoylthio ester possessing the cocaine absolute configuration. In: Journal of the American Chemical Society. Band 124, Nummer 14, April 2002, S. 3661–3668, PMID 11929256. doi:10.1021/ja012376y.
- ↑ Zur Geschichte des Novocains ( vom 5. März 2016 im Internet Archive) Apothekerzeitung Heft 13/14 (1950) S. 175.
- ↑ U. Glade: Die Geschichte der Anästhesie ( vom 18. Mai 2015 im Internet Archive), Universität Bremen.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 20 und 26.
- ↑ Vgl. Otalgan. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. CIX (Anzeige der Südmedica GmbH, München).
- ↑ A. Villar-Garea, M. F. Fraga, J. Espada, M. Esteller: Procaine is a DNA-demethylating agent with growth-inhibitory effects in human cancer cells. In: Cancer Research. Band 63, Nummer 16, August 2003, S. 4984–4989, PMID 12941824.
- ↑ Heinrich L’Allemand: Wiederbelebung. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 217–228, hier: S. 222–223.
- ↑ Axel Kleemann, Jürgen Engel, Bernd Kutscher und Dietmar Reichert: Pharmaceutical Substances, 4. Auflage (2000), 2 Bände erschienen im Thieme-Verlag Stuttgart, ISBN 978-1-58890-031-9; seit 2003 online mit halbjährlichen Ergänzungen und Aktualisierungen.
- ↑ Vgl. auch Carney: Novocainähnliche Ester. John Wiley & Sons, New York 1951.
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Geroaslan-H3 (A), Gerovital H 3 (A), Hewedolor (D), K.H.3 (A), Lophakomp-Procain (D), Novanaest (A), Pasconeural (D), diverse Generika (D)
Gero-H3-Aslan (D), Fortepen (A), Ginvapast (CH), NeyChon (D), NeyGero (D), NeyGeront (D), Otalgan (D, CH), Otosan (CH), Retarpen compositum (A)