Rhodium(III)-oxid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Rh3+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Rhodium(III)-oxid | |||||||||||||||
| Andere Namen |
Dirhodiumtrioxid | |||||||||||||||
| Verhältnisformel | Rh2O3 | |||||||||||||||
| Kurzbeschreibung |
grauschwarzer geruchloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 253,81 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
8,20 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Rhodium(III)-oxid ist eine anorganische chemische Verbindung des Rhodiums aus der Gruppe der Oxide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Rhodium(III)-oxid kann durch Reaktion von wasserfreien Rhodium(III)-salzen wie Rhodium(III)-chlorid mit Sauerstoff bei 750–800 °C gewonnen werden. Es kann auch direkt aus den Elementen gewonnen werden.[3] Das Rhodium(III)-oxidhydrat kann durch Fällung einer wässriger Natriumhexachlororhodat- oder Kaliumhexachlororhodat-Lösung mit Natrium- oder Kaliumhydroxid-Lösung gewonnen werden.[4]
Eigenschaften
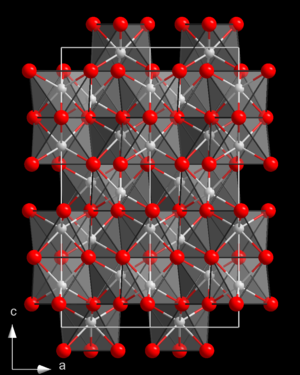
[Bearbeiten | Quelltext bearbeiten]Rhodium(III)-oxid ist ein paramagnetischer[3] schwarzgrauer geruchloser Feststoff,[1] der weder in Wasser noch in Säuren löslich ist. Er hat eine Kristallstruktur isotyp zu der von Aluminium(III)-oxid (Korund) mit der Raumgruppe R3c (Raumgruppen-Nr. 167) und den Gitterparametern a = 547 pm und α = 55°40'. Bei 750 °C geht diese in eine orthorhombische Form über.[5] Sein Pentahydrat (Rhodiumoxidhydrat) ist ein blassgelbes Pulver, das in Wasser unlöslich und in Säuren löslich ist. Durch Umsetzung mit Salpetersäure gelangt man zu Rhodium(III)-nitrat.[4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Datenblatt Rhodium(III) oxide, anhydrous, 99.9% (metals basis), Rh 80.6% min bei Alfa Aesar, abgerufen am 21. Juni 2023 (Seite nicht mehr abrufbar).
- ↑ a b c Eintrag zu Rhodium(III) oxide, anhydrous, 99.9% (metals basis), Rh 80.6% min bei Thermo Fisher Scientific, abgerufen am 8. Februar 2024.
- ↑ a b Aaron Wold, Kirby Dwight: Solid State Chemistry: Synthesis, Structure, and Properties of Selected ... Springer, 1993, ISBN 0-412-03621-5, S. 119 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1634.
- ↑ J. M. D. Coey: The crystal structure of Rh2O3. In: Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 26, S. 1876–1877, doi:10.1107/S0567740870005022.

