Rossmann-Faltung
Zur Navigation springen
Zur Suche springen
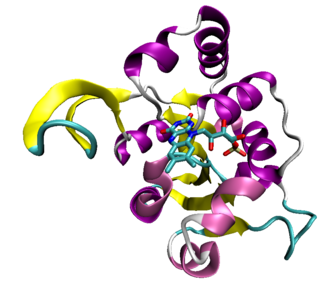
Die Rossmann-Faltung ist eine funktionelle Supersekundärstruktur bzw. ein Motiv in Proteinen, bei dem sich zwei Einheiten der Form beta-alpha-beta-alpha-beta – also β-Faltblätter verbunden über α-Helices – zusammenlagern, um Dinukleotide wie Nicotinamidadenindinukleotid (NAD+) zu binden.
Die Rossmann-Faltung ist eine der ersten identifizierten, häufig auftretenden Strukturdomänen. Sie wurde nach ihrem Entdecker Michael Rossmann benannt und stellt vermutlich eine ursprüngliche Dinucleotidbindungsdomäne dar. Sie tritt u. a. bei den drei Dehydrogenasen der Glykolyse auf.[2]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Donald Voet, Judith G. Voet, Charlotte W. Pratt: Lehrbuch der Biochemie. Übersetzung herausgegeben von Annette G. Beck-Sickinger und Ulrich Hahn. Wiley-VCH Verlag, 2002
- J.M. Berg, J.L. Tymoczko, L. Stryer: Biochemie. Aus dem Englischen übersetzt von B. Häcker, A. Held, B. Jarosch, C. Lange, K. Mahlke, G. Maxam, L. Seidel, N. Zellerhoff. 6. Auflage, Spektrum, 2007
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Hanukoglu I: Proteopedia: Rossmann fold: A beta-alpha-beta fold at dinucleotide binding sites. In: Biochem Mol Biol Educ. 43. Jahrgang, Nr. 3, 2015, S. 206–209, doi:10.1002/bmb.20849, PMID 25704928.
- ↑ Michael G. Rossmann, Dino Moras & Kenneth W. Olsen: Chemical and biological evolution of a nucleotide-binding protein. In: Nature. 250. Jahrgang, Nr. 5463, Juli 1974, S. 194–99.