Shell Higher Olefin Process

Der Shell Higher Olefin Process (SHOP, oft redundant auch als SHOP-Prozess bezeichnet) ist ein chemischer Prozess zur Herstellung von linearen α-Olefinen. Der Prozess umfasst drei wesentliche Reaktionen: die homogenkatalytische Oligomerisierung von Ethen mittels eines metallorganischen Nickelchelatkomplexes, die Isomerisierung langkettiger α-Olefine in interne Olefine sowie die Metathese der internen Olefine, welche wiederum in α-Olefine überführt werden. Die Oligomerisierungsreaktion wird in 1,4-Butandiol durchgeführt, in dem die entstehenden α-Olefine kaum löslich sind und so einfach von der Katalysatorlösung zu trennen sind. Es handelt sich um das erste Beispiel einer industriell genutzten Heterogenisierung eines homogenen Katalysators.
Die grundlegende Reaktion der Ethen-Oligomerisierung wurden in den 1960er Jahren von Wilhelm Keim in den Laboratorien der Shell Development Company in Emeryville, Kalifornien, entdeckt. Das technische Verfahren wurde in den 1970er Jahren von der Royal Dutch Shell entwickelt und kommerzialisiert.
Der Shell Higher Olefin Process ermöglicht die Herstellung einer breiten Palette von Olefinen mit unterschiedlichen Kettenlängen. Diese dienen als Zwischenprodukte für die Herstellung einer Vielzahl von Endprodukten, darunter Waschmittel, Schmierstoffe und Polymere. Die Produktverteilung lässt sich durch die Variation der Prozessbedingungen der einzelnen Verfahrensschritte verändern. Dadurch kann das Produktspektrum an die Marktbedürfnisse angepasst werden, was zu einer Steigerung der Wirtschaftlichkeit des Prozesses beiträgt. Ein weiterer Ansatz zur Steuerung der Oligomerverteilung in die gewünschte Richtung stellt das Ligandendesign dar. Durch Variation der Liganden kann sowohl eine Verteilung in Richtung wachsartiger Produkte als auch zu überwiegend flüssigen Produkten erzielt werden. Im Jahr 2019 betrug die Produktionskapazität mehr als eine Million Tonnen α-Olefine pro Jahr.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Frühe Arbeiten
[Bearbeiten | Quelltext bearbeiten]Für die Umwandlung von Ethen in höhermolekulare Olefine wurde eine Vielzahl von Oligomerisierungskatalysatoren eingesetzt. Der erste dazu verwendete Katalysator war 1938 Nickel(II)-oxid auf Kieselgur.[1] Später wurde über Nickeloxid-Katalysatoren auf Trägermaterialien wie Alumosilicaten berichtet. Die erzeugten Olefine waren hauptsächlich Di-, Tri- und Tetramere des Ethens.[2] Heterogene Nickelkatalysatoren, die teilweise mit Schwefel vergiftet wurden, verschoben zwar die Kettenlängenverteilung bei der Oligomerisierung von Ethen in Richtung höhermolekularer Produkte, jedoch weder die Ausbeute noch deren Linearität waren zufriedenstellend.[3]
Umweltprobleme
[Bearbeiten | Quelltext bearbeiten]
In den 1960er Jahren führten Waschmittel auf Basis von verzweigten Fettalkoholen, die nur schwer biologisch abbaubar waren, zu Problemen mit Schaumbergen auf Gewässern. Um diese negativen Auswirkungen zu vermeiden, bestand ein großer Anreiz, Waschmittel auf Basis unverzweigter Fettalkohole zu entwickeln, die leichter biologisch abbaubar waren.[4] Die auf unverzweigten Fettalkoholen basierenden Detergenzien zeigten gute Wascheigenschaften bei niedrigen Temperaturen. Durch die Toleranz dieser Detergenzien gegenüber Wasserhärte konnte außerdem der Phosphatgehalt der Waschmittel verringert werden.[5]
In den 1960er Jahren baute Shell Chemicals daher eine Hydroformylierungsanlage zur Herstellung von unverzweigten Fettalkoholen aus Olefinen in Geismar, Louisiana. Die verwendeten Olefine wurden ursprünglich durch die Chlorierung langkettiger Paraffine und der anschließenden Abspaltung von Chlorwasserstoff hergestellt. Die auf diese Weise erzeugten Olefine verkürzten jedoch die Lebensdauer des bei der Hydroformylierung verwendeten Cobaltkatalysators.[5]
Daher suchte Shell nach alternativen Quellen für α-Olefine. Zudem stand durch den Bau eines Gasöl-Crackers Ethen in großen Mengen zur Verfügung. Vor diesem Hintergrund wurde die Forschungsabteilung beauftragt, die Oligomerisierung von Ethen zu α-Olefinen zu untersuchen.[5]
Entwicklung des Shell Higher Olefin Process
[Bearbeiten | Quelltext bearbeiten]
Der Prozessschritt der Ethenoligomerisierung geht auf Arbeiten von Karl Ziegler und Günther Wilke am Max-Planck-Institut für Kohlenforschung in Mülheim an der Ruhr zurück. Im Rahmen der Untersuchungen zur Reaktion von Triethylaluminium mit Ethen zeigte sich, dass die Anwesenheit geringer Nickelsalzmengen die Reaktion in Richtung der Bildung von 1-Buten lenkt. Dieses als „Nickeleffekt“ bezeichnete Phänomen markierte den Beginn der Entwicklung einer Reihe von Katalysatoren für unterschiedliche Einsatzbereiche.[6]
Wilhelm Keim modifizierte den Nickel-Katalysator durch Einführung eines Phosphor-Sauerstoff-Liganden. Die Möglichkeit der Katalysatorabtrennung durch Heterogenisierung wurde durch Zufall gefunden. Zunächst wurde bei den Versuchen Toluol als Lösungsmittel verwendet. Durch eine Verwechslung benutzte ein Laborassistent Acetonitril statt Toluol, woraufhin sich im Reaktor zwei Phasen bildeten: Eine Phase bestand aus reinen α-Olefinen, die zweite enthielt den Katalysator und Acetonitril. Dadurch ergab sich die Möglichkeit der Katalysatorrückgewinnung in einem zweiphasigen Verfahren.[7] Weitergehende Forschungen an den Forschungslaboratorien der Shell in Emeryville und Amsterdam führten zur Entwicklung des Verfahrens.
Großtechnische Umsetzung
[Bearbeiten | Quelltext bearbeiten]Die erste kommerzielle Anlage wurde 1977 in Geismar, Louisiana, in Betrieb genommen.[8] Die Anlagenkapazität wurde durch den Bau von zwei weiteren Einheiten in den Jahren 1989 und 2002 erhöht. Die Anlagen verfügte dadurch über eine Gesamtkapazität von 910.000 Tonnen.[9] Die vierte SHOP-Produktionseinheit in Geismar mit einer Produktionskapazität von 425.000 Tonnen pro Jahr wurde 2018 fertiggestellt.[10] Die Gesamtkapazität der SHOP-Anlagen in Geismar betrug 2019 etwa 1,3 Millionen Tonnen pro Jahr.[11]
In Stanlow im Vereinigten Königreich wurde 1982 eine weitere SHOP-Anlage in Betrieb genommen. Im Jahr 1989 erfolgte dort eine Kapazitätserhöhung auf insgesamt 270.000 Tonnen.[9] Die SHOP-Anlagen in Stanlow wurde nach einem Großfeuer 2018 außer Betrieb genommen und schließlich 2020 abgerissen.[12][13]
Andere Oligomerisierungsprozesse wurden von Chevron Phillips Chemical, Ethyl Corporation, Orlen Unipetrol, Mitsubishi Chemical Group und Asahi Kasei auf Basis von Ziegler-Katalysatoren entwickelt, Idemitsu Kōsan verwendet einen Zirkonium-basierten Katalysator.[9] α-Olefine können ferner durch Cracken oder die Dehydrierung von Paraffinen sowie die Dehydratisierung von Alkoholen hergestellt werden.
Die drei zuletzt genannten Verfahren sind jedoch nicht mehr die bevorzugten Wege zur Herstellung von α-Olefinen.[14]
Rohmaterial
[Bearbeiten | Quelltext bearbeiten]
Das Ethen zur Herstellung der α-Olefine stammt aus dem Fluid Catalytic Cracking, bei dem schweres Gasöl mit einer Siedetemperatur über 340 °C bei hohen Temperaturen mit einem heterogenen Katalysator gecrackt wird. Als Katalysator wird ein Kontakt auf der Basis von Zeolithen verwendet. Traditionell wird Gasöl in Benzin und Dieselkraftstoff umgewandelt, die Wahl der Betriebsbedingungen und des Katalysators erlaubt eine Optimierung zu anderen FCC-Produkten wie Ethen.[15]
Katalysatoren
[Bearbeiten | Quelltext bearbeiten]Die Reaktion wird durch einen Nickel-Phosphan-Komplex der Art (C6H5)2P(CH2)2COONiH mit Diphenylphosphinoessigsäure
oder 2-Diphenylphosphinobenzoesäure als Ligand katalysiert.[16][17]
Der Katalysator kann in-situ durch die Reduktion von Nickel(II)-chlorid-Hexahydrat mit Natriumborhydrid in Gegenwart von Alkalihydroxiden und dem Chelatliganden hergestellt werden. Die Zugabe als Cyclooctadien-Komplex reduziert jedoch den Nickelsalz- und Natriumborhydridverbrauch erheblich.[8] Die Deaktivierung des Katalysators erfolgt möglicherweise durch die Bildung von zweifach mit P-O-Liganden chelatisierten Nickelkomplexen.[18]
Durch den Einsatz von PO-Liganden mit guter Löslichkeit in polaren Lösungsmitteln lässt sich auch die Löslichkeit des Katalysatorkomplexes in polaren Lösungsmitteln optimieren. Dies kann etwa durch die Einführung einer Sulfonylgruppe am Liganden geschehen, die die Löslichkeit des Komplexes erhöht. Die verwendeten Nickel(II)-Katalysatoren weisen eine hohe Toleranz gegenüber solchen funktionellen Gruppen auf.[19] Dadurch erleichtert sich die Trennung des Katalysators vom Produktstrom bei einer zweiphasigen Verfahrensweise.[20]
Die steigende Nachfrage nach linearen α-Olefinen im C4- bis C10-Bereich im Vergleich zum C12+-Bereich macht die selektive Bildung von leichten α-Olefinen aus Ethen zu einem wichtigen Thema für die industrielle Forschung. Die Reaktivität des Nickelkomplexes kann durch das Ligandendesign angepasst werden, wodurch die für die industrielle Produktion erforderliche Selektivität erzielt werden kann. Durch ein gezieltes Ligandendesign ist es möglich, Ethen selektiv zu α-Olefinen mit einer kürzeren Kettenlängenverteilung zu oligomerisieren. Des Weiteren ist die Di- oder Trimerisierung von Ethen zu 1-Buten oder 1-Hexen als Hauptprodukt möglich.[21][22]
Die Isomerisierung zu internen Olefinen erfolgt mittels typischen Isomerisierungskatalysatoren wie Magnesiumoxid oder Natrium/Kalium auf Aluminiumoxid, wobei etwa 90 % zu internen Olefinen isomerisiert werden.[8] Für die Metathese der internen Olefine werden Katalysatoren auf Basis von Molybdaten auf Aluminiumoxidträgern (MoO3/Al2O3) eingesetzt, die in einem Temperaturbereich von 100 bis 200 °C arbeiten.[23]
Verfahren
[Bearbeiten | Quelltext bearbeiten]Im Verlauf des Shop-Verfahrens fallen sechs verschiedene Fraktionen mit unterschiedlicher Zusammensetzung an. Diese Fraktionen (a–f) sind in der schematischen Anlagenzeichnung entsprechend gekennzeichnet. Die Fraktionen c, d und f werden dem Prozess entnommen und industriell verwendet. Die Fraktionen a, b und e sind zwar industriell nicht relevant, können aber dem Prozess zurückgeführt werden und zu den anderen Fraktionen umgewandelt werden.

Die Anlage zum SHOP-Verfahren ist in sechs verschiedene Bestandteile gegliedert. Neben zwei Destillationskammern (3) und (6) zur Auftrennung in verschiedene Fraktionen, besteht die Anlage aus dem eigentlichen Oligomerisationsreaktor (1), dem Separator (2), dem Isomerisierungsreaktor (4) und dem Reaktor zur Metathese (5).
Die jeweiligen Kettenlängen der entstehenden α-Olefine können über folgende Tabelle zugeordnet werden:
| Fraktion | kürzeste Kettenlänge |
längste Kettenlänge |
Bemerkung |
|---|---|---|---|
| a | 4 | ∞ | nur α–Olefine mit einer geraden Anzahl an Kohlenstoffatomen |
| b | 20 | ∞ | nur α–Olefine mit einer geraden Anzahl an Kohlenstoffatomen |
| c | 4 | 10 | nur α–Olefine mit einer geraden Anzahl an Kohlenstoffatomen |
| d | 12 | 18 | nur α–Olefine mit einer geraden Anzahl an Kohlenstoffatomen |
| e | 14 | ∞ | Olefine mit mittelständigen Doppelbindungen; auch ungerade Anzahl an Kohlenstoffatomen möglich |
| f | 11 | 14 | Olefine mit mittelständigen Doppelbindungen; auch ungerade Anzahl an Kohlenstoffatomen möglich |
| g | 4 | 10 | Olefine mit mittelständigen Doppelbindungen; auch ungerade Anzahl an Kohlenstoffatomen möglich |
| Kettenlänge | Gew.-% |
|---|---|
| C4 | 7 - 14 |
| C6 – C10 | 25 - 41 |
| C12 – C14 | 15 - 18 |
| C16 – C18 | 11 - 15 |
| C20+ | 14 - 42 |
Oligomerisation und Separation
[Bearbeiten | Quelltext bearbeiten]
Im Oligomerisationsreaktor (1) wird Ethen in Gegenwart einer flüssigen Katalysatorphase aus einem Nickel-Phosphan-Komplex zu längerkettigen α-Olefinen umgesetzt. Die Konzentration des Katalysators liegt im Bereich von etwa 10 bis 50 parts per million. Es entsteht eine besonders reine Form von α-Olefinen mit nur einer Doppelbindung mit einer Ausbeute von 96 bis 98 % über den gesamten Bereich von C4 bis C30+. Die Linearität der α-Olefine beträgt bis zu 99 %.[9] Dieser Schritt wird in einem polaren Lösungsmittel wie 1,4-Butandiol durchgeführt. Da die gebildeten α-Olefine darin nicht löslich sind, können diese einfach abgetrennt werden. Dabei entsteht eine Mischung von geradzahligen α-Olefinen mit einer Schulz-Flory-Verteilung.[24]
Im nächsten Schritt wird im Separator (2) das Produktgemisch von der Katalysatorphase getrennt und die den Katalysator enthaltende 1,4-Butandiol-Phase in den Oligomerisierungsreaktor zurückgeführt. Die Oligomere werden mit frischem 1,4-Butandiol gewaschen, um etwaige Katalysatorreste zu entfernen. Dadurch wird nicht nur die Produktqualität verbessert, sondern auch die Prozessstabilität. Katalysatorreste können in weiteren Verfahrensschritten ansonsten zur Bildung von Polyethylen führen, das sich in den Prozessanlagen ablagern kann. Anschließend wird das Produktgemisch in die Destillationskolonne (3) geleitet. Überschüssiges Ethen wird in den Reaktor (1) zurückgeleitet.[9]
Am Ende der ersten Destillation verlassen drei Fraktionen die Kammer. Die Fraktion der Produkte mit Kettenlängen zwischen zwölf und 18 Kohlenstoffatomen werden dem Prozess abgeführt und in der Industrie weiterverarbeitet. Sie sind die Hauptprodukte des SHOP-Verfahrens. Die Fraktion der Kettenlängen zwischen vier und zehn Kohlenstoffatomen werden zum Teil abgeführt und zum Teil in den Isomerisierungsreaktor (4) geleitet. Die Fraktion der α–Olefine, die mehr als 20 Kohlenstoffatome besitzen, werden vollständig in den Isomerisierungsreaktor (4) geleitet.
Im ersten Schritt findet die Ethen-Oligomerisierung bei Temperaturen von 80 bis 120 °C und einem Druck von 70 bis 140 bar statt. Die Nickelkonzentration liegt im Bereich von 10 bis 50 Parts per million. Die Reaktionsgeschwindigkeit wird durch die Geschwindigkeit der Katalysatorzugabe gesteuert. Weiterhin ist ein hoher Ethenpartialdruck erforderlich, um hohe Reaktionsgeschwindigkeiten und Produktlinearität zu erreichen.[9]
| Produkt | Gew.-% |
|---|---|
| α-Olefine | 96 - 98 |
| Verzweigte Olefine | 1 - 3 |
| Paraffine | < 0,1 |
| Diene | - |
| Monoolefine | 99,9 |
Isomerisierung
[Bearbeiten | Quelltext bearbeiten]Bei der Isomerisierung werden die α–Olefine in Verbindungen umgewandelt, die mittelständige Doppelbindungen besitzen. In diesem Prozessschritt bleibt also die Kettenlänge der Moleküle konstant, verändert wird lediglich die Lage der Doppelbindung. Die Reaktion findet in gelöstem Magnesiumoxidkatalysator bei milden Reaktionsbedingungen statt. Die Temperatur beträgt zwischen 80 und 140 °C und der Druck zwischen 3 und 20 bar.
Metathese
[Bearbeiten | Quelltext bearbeiten]Im nächsten Schritt erfolgt eine Metathese im Metathesereaktor (5), wodurch ein Gemisch aus vorwiegend langkettigen internen Olefinen entsteht. Bei diesem Prozess können Ketten mit einer ungeraden Anzahl an Kohlenstoffatomen entstehen.
Durch eine Ethenolyse, eine Metathese im Ethenüberschuss, werden die langkettigen internen Olefine wieder zu α-Olefinen umgesetzt.[25] Die entstehenden Olefine werden wiederum destillativ aufgetrennt. Der Prozess der Isomerisierung und Metathese wird mehrfach durchlaufen, bis die kommerziell nicht relevanten Fraktionen in interne und α-Olefine mit der gewünschten Kettenlänge umgesetzt sind.
Produkte
[Bearbeiten | Quelltext bearbeiten]Die α-Olefine finden in einer Vielzahl von wichtigen Segmenten der chemischen Industrie Verwendung. Dazu gehören Polyethylen-Co-Monomere, synthetische Schmiermittel, Zwischenprodukte für Reinigungsmittel, Ölfeldchemikalien, Papierleimungsmittel, Schmiermitteladditive und Rheologiemodifikatoren für Wachse sowie eine Vielzahl von weiteren Zwischenprodukten für Fein- und Spezialchemikalien. Von den verschiedenen Verfahren gilt der SHOP-Prozess hinsichtlich der Produktverteilung als besonders flexibel. Die Herausforderung besteht in der Steuerung des Prozesses, sodass Produkte für die sehr unterschiedlichen Märkte bereitgestellt werden können.[26]
Der Markt für lineare α-Olefine im C4- bis C8-Bereich wuchs zwischen 2016 und 2021 aufgrund der steigenden Nachfrage nach linearem Polyethylen niedriger Dichte von rund 7 Millionen Tonnen pro Jahr auf 8,5 Millionen Tonnen. Die gezielte Herstellung der drei kurzkettigen α-Olefine 1-Buten, 1-Hexen und 1-Octen außerhalb der klassischen Schulz-Flory-Verteilung des SHOP-Verfahrens stellt ein vielversprechendes Ziel für die nickelkatalysierte Ethen-Oligomerisierung dar.[19] Die Größe des globalen α-Olefin-Marktes im Jahr 2023 wurde auf 10,42 Milliarden US-Dollar geschätzt, wobei die Kosten für Ethen wesentlich den Preis beeinflussen.[27]
| Kettenlänge | Anwendung |
|---|---|
| C4 – C8 | Polyethylen Co-Monomer |
| C6 – C8 | Niedermolekulare Fettsäuren und Mercaptane |
| C6 – C10 | Weichmacher-Alkohole |
| C10 – C12 | Polyalphaolefine und andere Additive für Schmiermittel, Aminoxide und Amine |
| C10 – C16 | Tensidalkohole, nichtionische Tenside und Ölfeldchemikalien |
| C16 – C18 | Ölfeldchemikalien, Schmieröladditive und Tenside |
| C20 – C30+ | Ölfeldchemikalien und Wachsersatzpolymere |
Durch Kombination von Oligomerisierung, Isomerisierung und Metathese gelingt es so, fast das komplette eingesetzte Ethen in die gewünschten Produktfraktionen zu überführen. Die α-Olefine werden durch Hydroformylierung in Fettalkohole überführt. Diese können durch direkte Sulfatierung in Fettalkoholsulfate überführt werden. Durch Reaktion mit Ethylenoxid entstehen Fettalkoholethoxylate, die entweder als nichtionische Tenside oder nach Sulfatierung in anionische Tenside überführt werden.

Die α-Olefine dienen als Co-Monomer bei der Herstellung von linear low density Polyethylene (LLD-PE).
α‐Olefine und Folgeprodukte
[Bearbeiten | Quelltext bearbeiten]Die Synthese von amorphen Polyalphaolefinen erfolgt durch Oligomerisierung von linearen α-Olefinen unter Verwendung unterschiedlicher Polymerisations- und Oligomerisationskatalysatoren wie Aluminiumchlorid oder Bortrifluorid. Octen, Decen und Dodecen werden sowohl rein als auch in Mischung zu synthetischen Schmierstoffen oligomerisiert. Diese finden Verwendung in Hochleistungsanwendungen der Automobilindustrie sowie der Industrie.[28]
Die gezielte Auswahl der Katalysatoren und der Reaktionsbedingungen erlaubt die Erzeugung von amorphen Polyalphaolefinen mit spezifischen Eigenschaften. Hochmolekulare Polymere auf Basis von Hexen, Octen, Decen und Dodecen werden als reibungsreduzierende Mittel etwa Rohöl und anderen Kohlenwasserstoffen beigemischt. Die Verwendung von polymeren, amorphen Polyalphaolefinen reduziert die Turbulenzen in der Nähe der Pipelinewand, was zu einer Verringerung des Reibungsdruckabfalls und des Widerstands entlang der Pipeline führt. Dies wiederum resultiert in einer Reduktion der Pumpverluste und senkt damit den Energiebedarf.[29]
Die Hydroformylierung der α-Olefine mit modifizierten Cobaltkomplexen, bei denen ein Carbonylligand durch ein Trialkylphosphinligand ersetzt ist, wie etwa Triethyl- oder Tributylphosphin, erlaubt die gleichzeitige Hydroformylierung und Hydrierung des entstehenden Fettaldehyds zum Fettalkohol in einer Tandem-Reaktion. Bei dem Verfahren wird häufig ein Überschuss an Wasserstoff im Synthesegasgemisch eingesetzt. Dadurch wird der zusätzliche Wasserstoffbedarf für die Hydrierung gedeckt und ein Austausch des Phosphinliganden durch Kohlenstoffmonoxid vermindert. Das Verfahren wurde 1968 bei Shell entwickelt.[30]
Durch die Metathese entstehen sowohl geradzahlige als auch ungeradzahlige Olefine. Durch die anschließende Hydroformylierung entstehen durch die Kettenverlängerung um ein C-Atom aus den geradzahligen Olefinen ungeradzahlige Fettalkohole und aus den ungeradzahligen Olefinen entstehen geradzahlige Fettalkohole. Außerdem sind die entstehenden Fettalkohole zum Teil 1-Methyl-verzweigt. Die Fettalkoholgemische sind daher nicht naturidentisch. Als Inhaltsstoffe von Kosmetika werden diese Fettalkoholethoxylategemische mit sowohl gerad- als auch ungeradzahligen Fettalkoholen als „Pareth“ bezeichnet, etwa Natriumparethsulfat.
Ein Sachverständigengremium für Inhaltsstoffe von Kosmetika gelangte zu der Einschätzung, dass die Verwendung der Ammonium- und Natriumsalze von C12/15-Parethsulfat, C10/15-Parethsulfat sowie C12/13-Parethsulfat als kosmetische Inhaltsstoffe in den gängigen Konzentrationen als sicher betrachtet werden kann.[31]
Interne Olefine und Folgeprodukte
[Bearbeiten | Quelltext bearbeiten]Interne Olefine werden im Rahmen von Offshore-Bohrungen als Bohrspülflüssigkeiten eingesetzt. Sie zeichnen sich durch die gleichen vorteilhaften Bohr-Eigenschaften wie Flüssigkeiten auf Öl-Basis aus, weisen im Unterschied zu diesen jedoch eine geringere Toxizität, eine schnellere biologische Abbaubarkeit sowie ein geringeres Bioakkumulationspotenzial auf.[32]
Mit Maleinsäureanhydrid werden interne Olefine in einer En-Reaktion bei Temperaturen von 180 bis 185 °C in Gegenwart von Stickstoff zu Alkenylbernsteinsäureanhydriden wie Dodecenylbernsteinsäureanhydrid umgesetzt. Alkenylbernsteinsäureanhydride werden in erster Linie als Oberflächen- und Masseleimungsmittel für Papier, Pappe und Karton eingesetzt.[33]
Langkettige interne Olefine werden zur Herstellung von Alkylphenolaten verwendet, welche zusammen mit Calciumcarbonat als Additiv in Motorölen zum Einsatz kommen. Dort neutralisieren sie saure, korrosive Verbrennungsprodukte von Kraftstoffen mit hohem Schwefelgehalt.[34]
Reaktionsmechanismus
[Bearbeiten | Quelltext bearbeiten]Der Prozess und seine Chemie wurden intensiv in der Arbeitsgruppe von Wilhelm Keim an der RWTH Aachen studiert, der als einer der Schlüsselfiguren bei der Entwicklung des Prozesses gilt.[21]
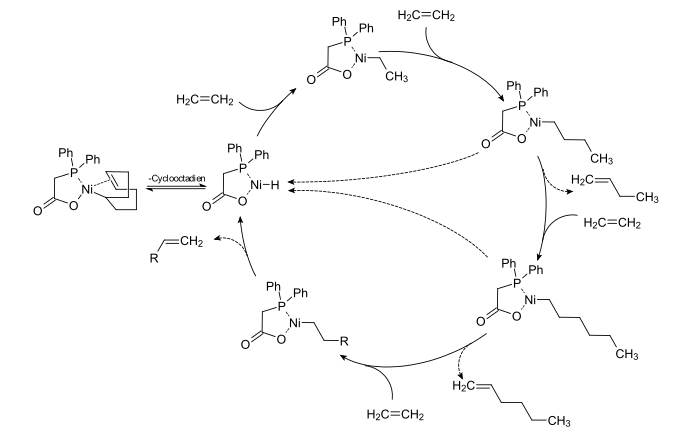
Das Kettenwachstum bei der Ethylenoligomerisierung kann auf unterschiedliche Weise erfolgen. Als aktiver Katalysator beim SHOP-Prozess gilt das Nickel-Hydrid, dass durch Abspaltung des Cyclooctadien-Liganden aus dem Start-Komplex gebildet wird. Bei der Oligomerisierung mit homogenen Katalysatoren auf Nickelbasis wird ein Ethen-Koordinations-Insertionsmechanismus angenommen, der als Cossee-Mechanismus bekannt ist.[35] Dabei erfolgt bei einem Nickelhydridkomplex zunächst eine π-Koordination des Ethens, gefolgt von der Insertion des Ethens in die Nickel-Wasserstoffbindung. Dieser Prozess führt zur Bildung eines Nickelalkylkomplexes, wobei die Koordinationsstelle wieder frei wird. Infolge weiterer, sukzessiver Koordinations-Insertionszyklen von Ethen am Nickelkomplex entstehen längerkettige Nickelalkylspezies. Der Kettenabbruch erfolgt durch eine β-H-Eliminierung, wodurch der ursprüngliche Metallhydridkomplex wieder freigesetzt wird.[36] Durch die β-Eliminierung entstehen α-Olefine verschiedener Kettenlänge, jedoch immer mit einer geradzahligen Anzahl von Kohlenstoffatomen. Durch das Design des Liganden kann die Kettenlängenverteilung der entstehenden Olefine beeinflusst werden.[37]
Literatur
[Bearbeiten | Quelltext bearbeiten]- Wilhelm Keim: Oligomerisierung von Ethen zu α-Olefinen: Erfindung und Entwicklung des Shell-Higher-Olefin-Prozesses (SHOP). In: Angewandte Chemie. 125, 2013, S. 12722–12726, doi:10.1002/ange.201305308.
- Dieter Vogt: SHOP Process. In: Boy Cornils, Wolfgang A. Herrmann: Aqueous-Phase Organometallic Catalysis. John Wiley & Sons, 1998, ISBN 978-3-527-29478-7, S. 541–547.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ A. Finiels, F. Fajula, V. Hulea: Nickel-based solid catalysts for ethylene oligomerization – a review. In: Catalysis Science & Technology. 4.8, 2014, S. 2412–2426, doi:10.1039/c4cy00305e.
- ↑ Patent US2581228: SiO2–Al2O3–NiO Catalysts and its preparation. Veröffentlicht am 1. Januar 1952, Erfinder: Grant C. Bailey, James A. Reid.
- ↑ Patent US3527839: Ethylene Oligomerization. Veröffentlicht am 8. September 1970, Erfinder: Peter W. Glockner, Kenneth W. Barnett.
- ↑ Jennifer Fuentes: An In Depth Guide To The SHOP Process. In: engineeringness.com. 10. November 2024, abgerufen am 14. November 2024 (englisch).
- ↑ a b c Wilhelm Keim: Oligomerization of Ethylene to α‐Olefins: Discovery and Development of the Shell Higher Olefin Process (SHOP). In: Angewandte Chemie International Edition. 52.48, 2013, S. 12492–12496, doi:10.1002/anie.201305308.
- ↑ K. Fischer, K. Jonas, P. Misbach, R. Stabba, G. Wilke: Zum „Nickel‐Effekt”︁. In: Angewandte Chemie. 85.23, 1973, S. 1001–1012, doi:10.1002/ange.19730852302.
- ↑ U. Rosenthal, A. Schulz: Contributions of Erhard Kurras to Organochromium Chemistry – From a Historical Perspective. In: European Journal of Inorganic Chemistry. 2022.2, 2021, doi:10.1002/ejic.202100749.
- ↑ a b c d Dieter Vogt: SHOP Process. In: Boy Cornils, Wolfgang A. Herrmann: Aqueous-Phase Organometallic Catalysis. John Wiley & Sons, 1998, ISBN 978-3-527-29478-7, S. 541–547.
- ↑ a b c d e f Dieter Vogt: Economical Applications (SHOP Process). In: Boy Cornils, Wolfgang A. Herrmann u. a. (Hrsg.): Multiphase Homogeneous Catalysis. Wiley-VCH, Weinheim, 2005, ISBN 978-3-527-30721-0, S. 330–334.
- ↑ Shell fährt Olefin-Anlage am US-Standort Geismar hoch. In: chemietechnik.de. 8. Januar 2019, abgerufen am 21. November 2024.
- ↑ Shell Advances Plans For Potential $1.2 Billion Louisiana Plant. In: opportunitylouisiana.gov. 20. Mai 2019, abgerufen am 17. November 2024 (englisch).
- ↑ David Holmes: Around 180 Stanlow jobs at risk after fire leads to closure of chemical plants. In: cheshire-live.co.uk. 13. Dezember 2018, abgerufen am 24. November 2024 (englisch).
- ↑ Chloe Nightingale: Essar Oil UK demolish Stanlow refinery SHOP stack. In: wirralglobe.co.uk. 14. Dezember 2022, abgerufen am 13. November 2024 (englisch).
- ↑ a b c Talwinder Singh, S. Mohan Naveen: A Review Paper on Production of linear alpha-Olefins by undergoing Oligomerization of Ethylen. In: International Journal of Engineering Applied Sciences and Technology. 2.4, 2017, S. 83–86, (online), (PDF; 0,2 MB).
- ↑ P. Bai u. a.: Fluid catalytic cracking technology: current status and recent discoveries on catalyst contamination. In: Catalysis Reviews. 61.3, 2018, S. 333–405, doi:10.1080/01614940.2018.1549011.
- ↑ Paul C. J. Kamer, Piet W. N. M. van Leeuwen: Phosphorus(III)Ligands in Homogeneous Catalysis: Design and Synthesis, John Wiley & Sons, 2012, ISBN 0-470-66627-7.
- ↑ M. Peuckert, W. Keim: A new nickel complex for the oligomerization of ethylene. In: Organometallics. 2.5, 1983, S. 594–597, doi:10.1021/om00077a004.
- ↑ J. Heinicke, M. Köhler, M. He, N. Peulecke, W. Keim: Phosphinophenolato Complexes for Use in Ethene Poly/Oligomerization. In: Phosphorus, Sulfur, and Silicon and the Related Elements. 177.8–9, 2002, S. 2119, doi:10.1080/10426500213407.
- ↑ a b H. Olivier-Bourbigou u. a.: Nickel Catalyzed Olefin Oligomerization and Dimerization. In: Chemical Reviews. 120.15, 2020, S. 7919–7983, doi:10.1021/acs.chemrev.0c00076.
- ↑ Wilhelm Keim: Vor‐ und Nachteile der homogenen Übergangsmetallkatalyse, dargestellt am SHOP–Prozeß. In: Chemie Ingenieur Technik. 56.11, 1984, S. 850–853, doi:10.1002/cite.330561108.
- ↑ a b Keiji Hirose, Wilhelm Keim: Olefin oligomerization with nickel chelate complexes. In: Journal of Molecular Catalysis. 73.3, 1992, S. 271–276, doi:10.1016/0304-5102(92)80081-q.
- ↑ A. Forestière, H. Olivier-Bourbigou, L. Saussine: Oligomerization of Monoolefins by Homogeneous Catalysts. In: Oil & Gas Science and Technology. 64.6, 2009, S. 649–667, doi:10.2516/ogst/2009027.
- ↑ C. Copéret u. a.: Bridging the Gap between Industrial and Well‐Defined Supported Catalysts. In: Angewandte Chemie International Edition. 57.22, 2018, S. 6398–6440, doi:10.1002/anie.201702387.
- ↑ Wilhelm Keim, Arno Behr, Günter Schmitt: Grundlagen der Industriellen Chemie. Salle Sauerländer, Frankfurt am Main, Berlin, 1986, ISBN 978-3-7941-2553-1, S. 138–141.
- ↑ Klaus Weissermel, Hans-Jürgen Arpe: Industrial Organic Chemistry: Important Raw Materials and Intermediates. Wiley-VCH Verlag 2003, ISBN 978-3-527-30578-0, S. 87.
- ↑ M. Morgan: Alpha-olefins – a question of balance. In: European Chemical News. 80, 2004, S. 16–18, (online).
- ↑ Alpha Olefin Market Size, Share And Growth Report, 2030. In: grandviewresearch.com. Abgerufen am 27. November 2024 (englisch).
- ↑ S. Ray, P. V. C. Rao, N. V. Choudary: Poly‐α‐olefin‐based synthetic lubricants: a short review on various synthetic routes. In: Lubrication Science. 24.1, 2011, S. 23–44, doi:10.1002/ls.166.
- ↑ M. Atiqullah, H. S. Al‐Asiri: Polyolefin Catalyst Research: A Product‐Driven Industrial Perspective. In: The Chemical Record. 22.7, 2022, doi:10.1002/tcr.202100321.
- ↑ G. M. Torres, R. Frauenlob, R. Franke, A. Börner: Production of alcohols via hydroformylation. In: Catalysis Science & Technology. 5.1, 2015, S. 34–54, doi:10.1039/c4cy01131g.
- ↑ V. C. Robinson u. a.: Final Report of the Amended Safety Assessment of Sodium Laureth Sulfate and Related Salts of Sulfated Ethoxylated Alcohols. In: International Journal of Toxicology. 29.4, 2010, S. 151S-161S, doi:10.1177/1091581810373151.
- ↑ J. Seyedmohammadi: The effects of drilling fluids and environment protection from pollutants using some models. In: Modeling Earth Systems and Environment. 3.1, 2017, doi:10.1007/s40808-017-0299-7.
- ↑ N. N. Shah, N. Soni, R. S. Singhal: Modification of proteins and polysaccharides using dodecenyl succinic anhydride: Synthesis, properties and applications—A review. In: International Journal of Biological Macromolecules. 107, 2018, S. 2224–2233, doi:10.1016/j.ijbiomac.2017.10.099.
- ↑ J. A. Griffiths u. a.: Physico-chemical characterisation of oil-soluble overbased phenate detergents. In: Journal of the Chemical Society. 91.4, 1995, S. 687–696, doi:10.1039/ft9959100687.
- ↑ P. Cossee: Ziegler-Natta catalysis I. Mechanism of polymerization of α-olefins with Ziegler-Natta catalysts. In: Journal of Catalysis. 3.1, 1964, S. 80–88, doi:10.1016/0021-9517(64)90095-8.
- ↑ G. J. P. Britovsek u. a.: Ethylene Oligomerization beyond Schulz–Flory Distributions. In: ACS Catalysis. 5.11, 2015, S. 6922–6925, doi:10.1021/acscatal.5b02203.
- ↑ Gadi Rothenberg: Catalysis. Concepts and Green Applications. Wiley-VCH, 2017, ISBN 978-3-527-80890-8, S. 3-29.