Sulfanilamid
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
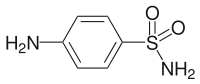
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Sulfanilamid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C6H8N2O2S | |||||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 172,21 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
10,58[3] | |||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Sulfanilamid ist ein Arzneistoff aus der Gruppe der Sulfonamide, der als Antibiotikum eingesetzt wurde.
Geschichte
[Bearbeiten | Quelltext bearbeiten]
Sulfanilamid wurde als erster Vertreter der Sulfonamide 1908 von Paul Gelmo synthetisiert[6][7][8], allerdings erkannte erst Gerhard Domagk mit seiner Veröffentlichung aus dem Jahre 1935 den chemotherapeutischen Nutzen der Sulfonamide (Sulfamidochrysoidin, Prontosil).[9] Sulfanilamid wurde ab 1935 therapeutisch eingesetzt, ist aber durch andere Sulfonamide ersetzt worden.
1937 führte die Sulfanilamid-Katastrophe in den USA, bei der mehr als hundert Personen durch mit Diethylenglykol zubereitetem Sulfanilamid-Sirup zu Tode kamen, zur Verabschiedung des Federal Food, Drug, and Cosmetic Act, des Kernes des Arzneimittelrechts der Vereinigten Staaten.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die dreistufige Synthese der Verbindung startet mit Acetanilid, welches mit Chlorsulfonsäure umgesetzt wird. Die Zielverbindung ergibt sich dann durch Umwandlung des Säurechlorids mittels Ammoniak zum Säureamid und anschließender Verseifung der Acetamidfunktion.[5]

Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Sulfanilamid gehört zur Stoffgruppe der Sulfonamide. Diese bestehen aus einem Benzolkern mit einer Amino- und einer Sulfonamidgruppe. Sie alle sind schwache organische Säuren und meist schlecht löslich in Wasser (die Natriumsalze der Sulfonamide sind meist gut wasserlöslich).
Verwendung
[Bearbeiten | Quelltext bearbeiten]Verwendet wird Sulfanilamid hauptsächlich als Antibiotikum.[10] Dabei wird es bei der Folsäuresynthese anstatt para-Aminobenzoesäure in die Folsäure eingebaut, die dadurch unwirksam wird. Bei Organismen, die Folsäure über die Nahrung aufnehmen müssen, wie zum Beispiel dem Menschen, wird deswegen keine Schädigung verursacht.
Weiterhin ist es Ausgangsstoff zur Erzeugung anderer Derivate.
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Sulfanilamid ist ein Abbauprodukt des Herbizids Asulam.[11][12]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Eintrag zu Sulfanilamid bei Vetpharm, abgerufen am 21. November 2011.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Eintrag zu Sulfanilamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 14. Dezember 2012. (JavaScript erforderlich)
- ↑ a b c Stephen R. Byrn: Solid State Chemistry of Drugs. Academic Press 1982, ISBN 0-12-148620-6, S. 104.
- ↑ a b Eintrag zu Sulfanilamide in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM) (Seite nicht mehr abrufbar)
- ↑ a b c Eintrag zu Sulfanilamid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. Mai 2014.
- ↑ a b c d A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag, Stuttgart 2000, ISBN 978-1-58890-031-9.
- ↑ R. Gelmo: Über Sulfamide der p-Aminobenzolsulfonsäurein J. Prakt. Chem. 77 (1908) 369ff.
- ↑ Rolf Werner Soukup: Chemiegeschichtliche Daten organischer Substanzen, Version 2020, S. 151 pdf.
- ↑ L. F. Fieser, M. Fieser in: Lehrbuch der organischen Chemie. 3. Auflage. Verlag Chemie, Weinheim a. d. Bergstraße 1957, S. 1193.
- ↑ Domagk: Beitrag zur Chemotherapie der bakteriellen Infektionen, Deutsch. Med. Wochenschrift, Band 61, 15. Februar 1935, S. 250–253,
Domagk: Chemotherapie der bakteriellen Infektionen, Angewandte Chemie, Band 46, 1935, S. 657–667. - ↑ Julius Hirsch: Der Wirkungsmechanismus der Sulfanilamid-Therapie. In: İstanbul Seririyatı. Nr. 5/6, 1942.
- ↑ Asulam Degradation Pathway. In: EAWAG Biocatalysis/Biodegradation Database. Abgerufen am 30. November 2021.
- ↑ European Food Safety Authority (EFSA), Maria Arena, Domenica Auteri, Stefania Barmaz, Alba Brancato: Peer review of the pesticide risk assessment of the active substance asulam (variant evaluated asulam‐sodium). In: EFSA Journal. Band 16, Nr. 4, April 2018, doi:10.2903/j.efsa.2018.5251, PMID 32625883, PMC 7009630 (freier Volltext).