Strontiumsulfid
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Sr2+ _ S2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Strontiumsulfid | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Verhältnisformel | SrS | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 119,69 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[3] | |||||||||||||||
| Dichte |
3,65 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Strontiumsulfid ist eine anorganische chemische Verbindung des Strontiums aus der Gruppe der Sulfide.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Strontiumsulfid kann durch Reaktion von Strontiumsulfat mit Kohlenstoff gewonnen werden.[5]
Strontiumsulfid hoher Reinheit lässt sich in kleinen Mengen sehr leicht durch Erhitzen von Strontiumcarbonat bei etwa 1000 °C in einem genügend starken Strom von Schwefelwasserstoff und Wasserstoff gewinnen.[2]
Ebenfalls möglich ist die Herstellung direkt aus den Elementen in einer inerten Atmosphäre.[5]
Eigenschaften
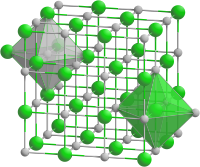
[Bearbeiten | Quelltext bearbeiten]Strontiumsulfid ist ein weißer Feststoff der an der Luft oxidiert und sich bei Feuchtigkeit zersetzt. Er hat eine Kristallstruktur vom Natriumchlorid-Typ (a = 6,020)[2] mit der Raumgruppe Fm3m (Raumgruppen-Nr. 225). Er zersetzt sich in Säuren unter Bildung von Schwefelwasserstoff.[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Strontiumsulfid wird für Nachleuchtfarben (blaugrünes Licht)[6] und zur Haarentfernung[7] verwendet.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu STRONTIUM SULFIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 24. Oktober 2021.
- ↑ a b c d Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 927.
- ↑ a b c Datenblatt Strontium sulfide, ≥99.9% bei Sigma-Aldrich, abgerufen am 25. März 2013 (PDF).
- ↑ a b c W. M. Haynes, David R. Lide, Thomas J. Bruno: CRC Handbook of Chemistry and Physics 2012-2013. CRC Press, 2012, ISBN 1-4398-8049-2, S. 4–92 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 140 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ von Karl-Heinz Lautenschläger, Werner Schröter: Taschenbuch der Chemie - Karl-Heinz Lautenschläger, Werner Schröter. Harri Deutsch Verlag, 2008, ISBN 978-3-8171-1761-1, S. 883 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Robert E. Krebs: The History And Use of Our Earth's Chemical Elements: A Reference Guide. Greenwood Publishing Group, 2006, ISBN 0-313-33438-2, S. 78 (eingeschränkte Vorschau in der Google-Buchsuche).



