Stufenwachstumsreaktion
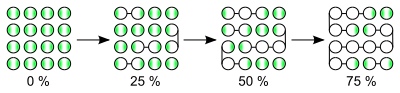
Stufenwachstumsreaktionen, auch Stufenwachstumspolymerisationen[1] genannt, sind Polymerisationen, die stufenweise in unabhängigen Reaktionen zur Bildung von Polymeren führen. Bei der Polymerisation reagieren Monomere zu Dimeren, Dimere mit Monomeren und Dimeren untereinander. Die Zwischenprodukte beliebigen Polymerisationsgrads reagieren schrittweise weiter zu Makromolekülen.[2] Damit unterscheiden sich Stufenwachstumsreaktionen grundsätzlich von Kettenpolymerisationen, bei denen fortlaufend nur Monomere an ein aktives Zentrum einer wachsenden Kette angelagert werden.
Es lassen sich zwei Arten der Stufenpolymerisation unterscheiden:
- Die häufigste Stufenpolymerisationen sind Polykondensationen: Jede Stufe ist eine Kondensationsreaktion, die unter Abspaltung kleiner Moleküle wie H2O, HCl, NH3 oder H3C–OH erfolgt.
- Bestimmte Stufenpolymerisationen sind Polyadditionen: Jede Stufe ist eine Additionsreaktion und erfolgt daher ohne Abspaltung kleiner Moleküle.
Die IUPAC empfiehlt die Sammelbezeichnung Stufenwachstumspolymerisationen (engl.: Step-growth polymerization) bzw. Stufenwachstumsreaktion nicht[3] und definiert Polykondensation[4] und Polyaddition[5] als eigenständige Formen der Polymerisation. Die beiden Polymerisationen haben die Gemeinsamkeit, erst bei sehr hohen Umsätzen Makromoleküle zu bilden.
Allgemeiner Reaktionsverlauf
[Bearbeiten | Quelltext bearbeiten]Als Erstes bilden sich aus den Monomeren (M) Dimere (P2) und dann Trimere (P3) oder Tetramere (P4). Bei Fortschritt des Wachstums reagieren Moleküle mit beliebigen Polymerisationsgrad miteinander. In der Reaktionsgleichung können i und j daher alle ganzzahligen Werte ≥ 1 tragen. Bei der Polykondensation wird bei jeder Reaktion ein Molekül (L), wie z. B. Wasser, abgespalten. Der Fortschritt des Wachstums ist ansonsten ähnlich der Polyaddition. Der eigentliche Reaktionsmechanismus einer betrachteten Polymerisation ist nicht relevant. So gibt es auch Ausnahmefälle, bei denen radikalische Kettenreaktionen als Polyaddition und nicht als radikalische Kettenpolymerisation verlaufen.[6]
 |
Stufenwachstumsreaktionen Erster Schritt Folgeschritte Allgemeine Schritte Polyaddition M + M → P2 P2 + M → P3
P2 + P2 → P4Pi + Pj → Pi+j Polykondensation M + M → P2 + L P2 + M → P3 + L
P2 + P2 → P4 + LPi + Pj → Pi+j + L
Für die Polymerisation sind Monomere erforderlich, die mindestens zwei funktionelle Gruppen tragen. Dabei sind zwei Varianten möglich: Die Umsetzung von Monomeren nur einer Art mit zwei unterschiedlichen funktionellen Gruppen (A–B-Monomere) und Reaktionen zwischen zwei unterschiedlichen Monomerarten (A–A-Monomere und B–B-Monomere), die jeweils zwei gleiche Funktion tragen. Um hohe Polymerisationsgrade zu erreichen, müssen A–A-Monomere und B–B-Monomere im Verhältnis 1:1 eingesetzt werden.
Typ funktionelle Gruppen allg. chemische Formel Struktur des Polymers A–B-Monomer Aminosäure mit einer
Aminogruppe und eine
CarboxygruppeHOOC–R–NH2 
A–A-Monomer und
B–B-MonomerDicarbonsäure und
DiaminHOOC–R1–COOH und
H2N–R2–NH2
Beispiel: Monomere für Polyamide
Polymerisationsgrad und Gewichtsbruchverteilung
[Bearbeiten | Quelltext bearbeiten]

Entwicklung des mittleren Polymerisationsgrad über den Umsatz P nach der Carothers-Gleichung. Der stöchiometrische Faktor r gibt das Verhältnis der A–A/B–B-Monomere an. Ist das Verhältnis 1:1 oder werden nur A–B-Monomere eingesetzt, ist r = 1. Gewichtsbruchverteilung wp über den Polymerisationsgrad Xi bei linearem Stufenwachstumsreaktion von A–B-Monomeren bei verschiedenen Umsätzen U nach der Schulz-Flory-Verteilung.
Die Auftragung des Umsatz P gegen die logarithmischen Darstellung des mittleren Polymerisationsgrad zeigt, dass erst bei hohen Umsätzen Makromoleküle gebildet werden. Besonders bei Polykondensationen wird ein sehr hoher Umsatz erst durch Nachbehandlung des Polymers bei Unterdruck und erhöhter Temperatur erreicht, wobei das Abspaltungsprodukt aus dem System entfernt wird. Ist ein Monomer unter diesen Bedingungen flüchtig und wurde im leichten Überschuss eingesetzt, lässt sich nachträglich Verhältnis 1:1 der Monomere einstellen und ein höherer Polymerisationsgrad erreichen. Die Gewichtsbruchverteilung zeigt die Verteilung der Kettenlängen in einem Polymer bei verschiedenen Umsätzen. Selbst bei einem Umsatz von 0,99 ist die Verteilung sehr breit und das Polymer enthält immer noch Oligomere. Klassische Kettenpolymerisationen führen übrigens unmittelbar nach Reaktionsstart zu Makromolekülen. Die Gewichtsbruchverteilungen ähneln der Verteilungen bei Stufenwachstumsreaktionen bei hohen Umsätzen.
Während bifunktionelle Monomere zu linearen Polymerketten führen, führt der Einsatz von (zusätzlichen) tri- oder mehrfunktionelle Monomere zu vernetzten Strukturen. Der mittlere Polymerisationsgrad steigt über den Umsatz deutlich früher und steiler. Es bilden sich unlösliche Polymere, was zu Gelierung der Reaktionsmasse führt.
Zur Herstellung von vernetzten Polymeren werden jedoch in der Regel zuerst nur oligomere Vorprodukte (Prepolymere) erzeugt und mit anderen Monomeren oder Prepolymeren und Hilfsstoffen zu Kunstharzen gemischt. Die Vernetzung wird erst durchgeführt, wenn der Kunstharz in die gewünschte Form oder Ort der Anwendung (z. B. bei Klebstoffen) gebracht worden ist, da das Reaktionsprodukt ein nicht mehr schmelzbarer bzw. formbarer Duroplast oder bei niedrigerer Vernetzung ein nicht mehr schmelzbares Elastomer ist.
Beispiele
[Bearbeiten | Quelltext bearbeiten]Aus der Struktur eines betrachteten Polymers lassen sich in der Regel nicht seine Ausgangsstoffe oder den Mechanismus seiner Polymerisation ableiten. Oft gibt es mehrere Wege, um zu dem Polymer zu gelangen.
Die Polykondensation
- von Dimethylterephthalat und Ethylenglycol führt zu dem Polyester Polyethylenterephthalat (PET)
- von AH-Salz, einem Salz aus Adipinsäure und Hexamethylendiamin führt zu dem Polyamid PA 6.6
- von dem A–B-Monomer ε-Aminocapronsäure führt zu dem Polyamid PA 6
Für die Herstellung von PA 6 gibt es effizientere Wege. Alle Beispiele führen zu Makromolekülen, die als Kunststoffe direkt eingesetzt werden. Bei der Polyaddition werden oft nur Prepolymere hergestellt, die zu Kunstharzen gemischt oder als Komponenten in 2-Komponenten-Harzen (Klebstoffe, Lacke) eingesetzt werden.
Die Polyaddition
- von 1,6-Hexandiisocyanat und 1,4-Butandiol führt zu einem Polyurethan
- von Bisphenol-A-diglycidylether und Bisphenol A führt zu einem Epoxidharz
Bei dem genannten Epoxidharz wird über die Lenkung mit Hilfe des stöcheometrischen Faktors r ein Prepolymer mit zwei Epoxy-Gruppen erzeugt. Der mittlere Polymerisationsgrad bleibt auch bei sehr hohen Umsatz niedrig und es bildet sich ein Diglycid-Polyether:
Dieser höhermolekulare Bisphenol-A-diglycidylether wird beispielsweise mit dem trifunktionellen Monomer Diethylentriamin als Härter umgesetzt, was zu vernetzten Makromolekülen führt.
Typische funktionelle Gruppen
[Bearbeiten | Quelltext bearbeiten]Typische Reaktionen von funktionelle Gruppen beim Stufenwachstum[7] 
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Stufenwachstums-Polymerisation. In: Römpp Online. Georg Thieme Verlag, abgerufen am 17. November 2019.
- ↑ Bernd Tieke: Makromolekulare Chemie, 3. Auflage, Wiley-VCH, Weinheim, 2014, S. 15ff.
- ↑ Ulrich Jonas, Patrick Theato: Glossar zu Begriffen mit Bezug zu Kinetik, Thermodynamik und Mechanismen von Polymerisationen (IUPAC-Empfehlungen), In: Angew. Chem., 2009, Bd. 121, Nr. 50, S. 9725–9738.
- ↑ Eintrag zu polycondensation. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.P04722 – Version: 2.3.3.
- ↑ Eintrag zu polyaddition. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.P04720 – Version: 2.3.3.
- ↑ Eintrag zu chain polymerization. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.C00958 – Version: 2.3.3.
- ↑ Erich Fitzer, Werner Fritz: Technische Chemie: Einführung in die chemische Reaktionstechnik, 3. Auflage, Springer, Berlin, Heidelberg, 1989, S. 413.