Plaque-Assay

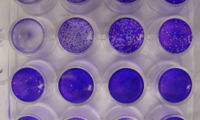
Ein Plaque-Assay (frz. plaque [plak] für „Platte; Fleck; Schild“; engl. assay, s. Assay) ist ein Verfahren zum Nachweis und zur Quantifizierung von infektiösen cytopathischen Viren, bei dem eine zu untersuchende Probe in unterschiedlichen Verdünnungen in eine Zellkultur eingebracht wird.
Prinzip
[Bearbeiten | Quelltext bearbeiten]Aufgrund eines cytopathischen Effektes kommt es nach Infektion von Zellen mit Viruspartikeln (synonym Virionen) zur Lyse der Zellen und deren unmittelbaren Nachbarzellen. Nach Lyse dieser Zellen gelangen freigesetzte Viruspartikel wiederum in benachbarte Zellen, das Virus breitet sich dadurch immer weiter aus. So kommt es zu einem Fleck in einem zuvor konfluenten Zellrasen, weil dort die Zellen lysiert wurden. Die Löcher im Zellrasen werden als Lysishof oder Plaque bezeichnet. Wird ein infizierter Zellrasen nach einer angemessenen Zeit, in der sich solche Plaques bilden konnten, fixiert und anschließend mit Methylenblau, Kristallviolett oder Neutralrot gefärbt und gewaschen, so erkennt man die Plaques als leere, nicht gefärbte Stellen, von denen sich die toten, lysierten Zellen beim Waschen teilweise abgelöst haben.[1] Die Plaques werden (zum Teil vollautomatisiert) gezählt und zusammen mit dem bekannten eingesetzten Volumen und dem Verdünnungsfaktor wird die Konzentration an infektiösen Viruspartikeln in der untersuchten Probe ermittelt, typischerweise als Infektiöse Einheiten je Milliliter, IE/ml, oder plaque forming units je Milliliter, PFU/ml.
Im Gegensatz zur Konzentrationsbestimmung von Viren im Blut oder Serum im Sinne einer Viruslast mittels Nachweis der viralen DNA oder RNA durch PCR und eine evtl. vorangehende Reverse Transkription, werden beim Plaque-Assay inaktivierte oder nicht-infektiöse Partikel innerhalb einer Viruspopulation nicht erfasst. Der Plaque-Assay ist daher ein direktes Maß für die Konzentration infektiöser Partikel in einer Probe. Da jedoch nicht alle auf die Zellen gegebenen infektiösen Virionen auch (nach der Virenzugabe und vor der Polymerzugabe) zu einer Infektion führen, und nicht alle Viruspartikel weit genug voneinander entfernt auf den Zellrasen gelangen, werden im Plaque-Assay tendenziell zu niedrige Werte ermittelt.
Zur Verbesserung der Genauigkeit der Methode können die Zellen nach der Infektion mit einem Polymer (z. B. low-melting Agarose[2] oder Zellulosepulver[3]) überschichtet werden. Diese Beschichtung verhindert während der drei Tage des Versuchs bei Stößen oder Vibrationen eine ungewollte Infektion von Zellen über das Kulturmedium und erlaubt nur direkte Infektionen von Nachbarzellen, da sonst möglicherweise über das Medium Plaques von Tochtervirionen der folgenden Generationen entstehen können und eine zu hohe Konzentration ermittelt würde. Da low-melting-Agarose auf etwa 50 °C erhitzt werden muss, besteht im Vergleich bei Zellulosepulver kein Risiko, dass die Zellen erhitzt werden.
Bei Viren, die keinen cytopathischen Effekt aufweisen, kann die Viruskonzentration über die tissue culture infectious dose of 50 % (TCID50, synonym cell culture infectious dose, CCID50) bestimmt werden.[4] Diese Methode basiert auf der Infektion der Zellkultur und einem beliebigen Nachweis (z. B. Indirect immunoperoxidase assay, Immunfluoreszenztest, DNA-Extraktion mit PCR, RNA-Extraktion mit RT-PCR), ob eine Zellkultur nach einem längeren Zeitraum (z. B. sieben Tage) überhaupt infiziert ist. Die Bestimmung der TCID50 umgeht das Problem der Infektion durch Tochtervirionen durch die Vermeidung einer Zählung von Plaques, da nur die Grenzverdünnungen ermittelt werden, bei der noch eine Infektion stattfindet.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Mit dem Plaque-Assay können nur Viruspartikel-Konzentration von Viren nachgewiesen werden, die eine verwendete Zelllinie infizieren können, darin replizieren und auch zur Lyse der Zellen führen wie z. B. Influenzaviren in MDCK-Zellen.[5] Der Plaque-Assay kann bei lytischen Viren auch zur Bestimmung der Viruslast, eines Virustiters oder der minimalen Infektionsdosis verwendet werden.
Der Plaque-Assay kann neben der Bestimmung der Konzentration infektiöser Virionen auch in einem Virus-Neutralisations-Assay (synonym Plaque-Reduktions-Assay) zum Nachweis infektionshemmender Antikörper gegen Teile des Virions dienen. Dafür werden Viren in bekannter Konzentration mit einer auf neutralisierende Antikörper zu testenden Probe vorher inkubiert und anschließend auf die Zellen gegeben. Binden die Antikörper an jene Oberflächenepitope der Viren, die zur Aufnahme in die Zelle notwendig sind, so sieht man im Plaque-Assay eine Verringerung der PFU/mL im Vergleich zu einer Negativkontrolle ohne diese Antikörper.[6]
Der Plaque-Assay wird auch genutzt, um die Wirkung von Desinfektionsmitteln zu untersuchen, bei denen das virale Genom nicht beeinträchtigt wird und unverändert nachweisbar bleibt, hingegen die Infektiosität der Virionen reduziert wird. Mit dem Plaque-Assay kann auch untersucht werden, wie hoch die Konzentration von infektiösen Viren in einer gesammelten Probe oder nach einer Virusanzucht im Zellkulturmedium ist. Bei vielen Viren (insbesondere RNA-Viren) ist nur ein geringer Prozentsatz der freigesetzten Virionen auch tatsächlich infektiös.
Der Vorläufer des Plaque-Assays erfasste bei Influenzaviren anhand der Veränderung des Amnions infizierter embryonierter Hühnereier die Anzahl focus forming units pro Milliliter.
Literatur
[Bearbeiten | Quelltext bearbeiten]- H. L. Bachrach, J. J. Callis et al.: A plaque assay for foot-and-mouth disease virus and kinetics of virus reproduction. Virology (1957) 4(2): S. 224–36 PMID 13496542
- P. D. Cooper: The plaque assay of animal viruses. Adv Virus Res (1961) 8: S. 319–78 PMID 13881155
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ M. B. Gonzalez-Hernandez, J. Bragazzi Cunha, C. E. Wobus: Plaque assay for murine norovirus. In: Journal of visualized experiments : JoVE. Nummer 66, 2012, S. e4297, ISSN 1940-087X. doi:10.3791/4297. PMID 22951568. PMC 3487293 (freier Volltext).
- ↑ C. R. Gaush, T. F. Smith: Replication and plaque assay of influenza virus in an established line of canine kidney cells. Appl Microbiol. 16(4):588-94 (1968). PMID 5647517.
- ↑ M. Matrosovich, T. Matrosovich, W. Garten, H. D. Klenk: New low-viscosity overlay medium for viral plaque assays. Virol J. 3:63 (2006). PMID 16945126.
- ↑ Y. Gao, I. Nankya, A. Abraha, R. M. Troyer, K. N. Nelson, A. Rubio, E. J. Arts: Calculating HIV-1 Infectious Titre Using a Virtual TCID50 Method. Methods in Molecular Biology Vol. 485 Page 27-35 (2008). PMID 19020816.
- ↑ A. J. Eisfeld, G. Neumann, Y. Kawaoka: Influenza A virus isolation, culture and identification. In: Nature protocols. Band 9, Nummer 11, November 2014, S. 2663–2681, doi:10.1038/nprot.2014.180, PMID 25321410.
- ↑ M. de Graaf, S. Herfst, E. J. Schrauwen et al.: An improved plaque reduction virus neutralization assay for human metapneumovirus. J Virol Methods 143(2): S. 169–74 (2007). PMID 17420056.