Technetium(IV)-oxid
| Kristallstruktur | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| _ Tc4+ _ O2− | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Technetium(IV)-oxid | ||||||||||||
| Andere Namen |
Technetiumdioxid | ||||||||||||
| Verhältnisformel | TcO2 | ||||||||||||
| Kurzbeschreibung |
braunschwarzer Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 129,91 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
6,9 g·cm−3[2] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Gefahren- und Sicherheitshinweise | |||||||||||||
 Radioaktiv | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Technetium(IV)-oxid ist eine anorganische chemische Verbindung des Technetiums aus der Gruppe der Oxide.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Technetium(IV)-oxid kann durch Zersetzung von Ammoniumpertechnetat bei 800 °C gewonnen werden.[1]
Es kann auch aus anderen Technetiumoxiden durch Erhitzung an Luft gewonnen werden.[4]
Das Dihydrat entsteht bei der Reaktion von Ammoniumtechnetiumhexachlorid mit einer Ammoniaklösung.[1]
Eigenschaften
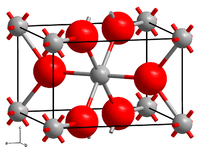
[Bearbeiten | Quelltext bearbeiten]Technetium(IV)-oxid ist braunschwarzer Feststoff. Er kristallisiert in einer verzerrten Rutil-Struktur des Molybdän(IV)-oxid. Bei 900 °C beginnt es zu sublimieren und disproportioniert oberhalb 1100 °C in Technetium und Technetium(VII)-oxid. Durch Salpetersäure oder Wasserstoffperoxid wird es zu TcO4− oxidiert.[1] Es ist schwach paramagnetisch.[5] Das Dihydrat geht bei Erhitzung auf 300 °C im Vakuum in die wasserfreie Form über.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f Georg Brauer (Hrsg.) u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band III, Ferdinand Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1599.
- ↑ a b H. Harry Julius Emeleus, A. G. Sharpe: Advances in Inorganic Chemistry and Radiochemistry. Academic Press, 1968, ISBN 0-08-057860-8, S. 21 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Die von der Radioaktivität ausgehenden Gefahren gehören nicht zu den einzustufenden Eigenschaften nach der GHS-Kennzeichnung. In Bezug auf weitere Gefahren wurde dieser Stoff entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1500.
- ↑ Joseph Steigman, William C. Eckelman, National Research Council (U.S.). Committee on Nuclear and Radiochemistry: The chemistry of technetium in medicine. National Academies, 1992, S. 57 (eingeschränkte Vorschau in der Google-Buchsuche).

![{\displaystyle {\ce {(NH4)2[TcCl6] + 4 NH4OH -> TcO2 . 2 H2O + 6 NH4Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/af19dff480ddf998bbd400d9e11cc4620cf1ac77)