Tegafur
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
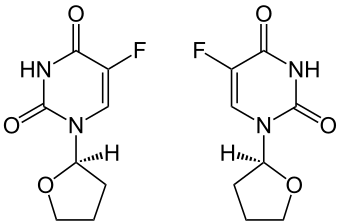
| 1:1-Gemisch aus (R)-Form (links) und (S)-Form (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tegafur | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C8H9FN2O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 200,17 g·mol−1 | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Tegafur (Freiname) ist ein Arzneistoff, der zur Chemotherapie von metastasiertem Krebs – besonders Magen-, Darm- und Brustkrebs – eingesetzt wird.[4] Der Wirkstoff gehört chemisch zur Gruppe der Nucleosid-Analoga. Tegafur ist ein Prodrug, das in der Leber in das zytostatisch wirksame 5-Fluoruracil (5-FU) umgewandelt wird. Anders als 5-FU kann Tegafur jedoch peroral verabreicht werden.
Tegafur wird auch in Kombination mit Uracil, mit dem die Verbindung ein 1:1-Addukt bildet, gegeben. Das Uracil hemmt das 5-FU-abbauende Enzym Dihydropyrimidin-Dehydrogenase (DPD).
Stereoisomerie
[Bearbeiten | Quelltext bearbeiten]Tegafur enthält ein stereogenes Zentrum und ist somit chiral, es gibt also zwei Enantiomere, (R)-5-Fluor-1-(tetrahydro-2-furyl)-uracil und das spiegelbildliche (S)-5-Fluor-1-(tetrahydro-2-furyl)-uracil. Der Arzneistoff Tegafur wird als Racemat [1:1-Gemisch aus (R)-5-Fluor-1-(tetrahydro-2-furyl)-uracil und (S)-5-Fluor-1-(tetrahydro-2-furyl)-uracil] eingesetzt.
Synthese
[Bearbeiten | Quelltext bearbeiten]Die Synthese von Tegafur geht vom 5-Fluoruracil aus, welches im ersten Schritt mittels Hexamethyldisilazan an den Amidfunktionen silyliert wird. Die Einführung der Tetrahydrofuranylgruppe erfolgt durch die Umsetzung mit 2-Chlortetrahydrofuran. Das Zielmolekül wird dann durch Abspaltung der Trimethylsilylgruppe mittels methanolischer Ammoniaklösung erhalten.[3][5]
Bei einer zweiten Synthesvariante wird 5-Fluoruracil direkt mit 2,3-Dihydrofuran in Gegenwart von Calciumchlorid und Pyridin zum Tegafur umgesetzt.[3]
Beide Synthesesequenzen ergeben das Racemat.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Racemisches Tegafur tritt in vier polymorphen Formen auf. Die α–, β– und δ–Formen können durch Lösungsmittelkristallisation erhalten werden. Die γ–Form bildet sich nach enantiotropen Umwandlungen aus der α– bzw. β–Form bei 162 °C bzw. 120 °C und schmilzt dann bei 175 °C. Die δ–Form zeigt einen Schmelzpunkt bei 165 °C.[1] Für die α– und β–Form sind mittels Röntgeneinkristalluntersuchungen die Kristallstrukturen untersucht worden. Die α–Form kristallisiert in einem triklinen Kristallgitter mit der Raumgruppe P1 (Raumgruppen-Nr. 1).[6][7] Für die β–Form wurde ein monoklines Kristallgitter mit der Raumgruppe P21/n (Nr. 14, Stellung 2) bestimmt.[8] Beide Formen bilden im Kristallgitter über Wasserstoffbrücken verknüpfte Dimere aus. Der Unterschied besteht darin, dass bei der α–Form eine Verknüpfung über die N-H-Gruppe und die harnstoffanaloge Carbonylstruktur und bei der β–Form diese über die N-H-Gruppe und die säureamidanaloge Carbonylstruktur erfolgt.[8]
Tegafur ist ein weißes bis cremefarbenes, nicht hygroskopisches, kristallines Pulver, das in Wasser löslich ist. Der pKa-Wert beträgt 7,98 und der Octanol-Wasser-Verteilungskoeffizient bei pH 2–6 beträgt 0,46, nimmt jedoch bei pH-Werten über 7 ab.[9] Neuere Untersuchungen beschreiben Cokristalle mit 2,4-Dihydroxybenzoesäure und p-Nitrophenol, die eine wesentlich bessere Löslichkeit als reines Tegafur aufweisen.[10]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Monopräparate
- Ftorafur (CZ, LV)
Kombinationspräparate
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g T. Uchida, E. Yonemochi, T. Oguchi, K. Terada, K. Yamamoto, Y. Nakai: Polymorphism of Tegafur: Physico-chemical Properties of Four Polymorphs. In: Chem. Pharm. Bull. 41, 1993, S. 1632–1635.
- ↑ a b Datenblatt Tegafur bei Sigma-Aldrich, abgerufen am 23. April 2011 (PDF).
- ↑ a b c d e f g A. Kleemann, J. Engel, B. Kutscher, D. Reichert: Pharmaceutical Substances – Synthesis, Patents, Applications. 4. Auflage. Thieme-Verlag Stuttgart 2000, ISBN 1-58890-031-2.
- ↑ N. I. Karev, N. G. Blokhina, E. K. Vozny, M. P. Pershin: Experience with ftorafur treatment in breast cancer. In: Neoplasma. 19, 1972, S. 347–350.
- ↑ E. Lukevits, A. Zablotskaya: Synthesis of Ftorafur (review). In: Chemistry of Heterocyclic Compounds. 27, 1992, S. 1271–1299, doi:10.1007/BF00515572.
- ↑ Y. Nakai, K. Yamamoto, K. Terada, T. Uchida, N. Shimizu, S. Nishigaki: The Crystal Structure of Ftorafur. In: Chem. Pharm. Bull. 30, 1982, S. 2629–2632, doi:10.1248/cpb.30.2629, (pdf)
- ↑ F. Needham, J. Faber, T. G. Fawcett: X-ray powder diffraction analysis of tegafur. In: Powder Diffraction. 21, 2006, S. 245–247, doi:10.1154/1.2210952.
- ↑ a b Y. Nakai, K. Yamamoto, K. Terada, T. Uchida, K. Yamaguchi, N. Shimizu: The crystal Structure of Tegafur (β–Form): Comparison with α–Form. In: Chem. Pharm. Bull. 34, 1986, S. 1242–1248, doi:10.1248/cpb.34.1242, (pdf)
- ↑ Assessment Report, 30. März 2011, ema.europa.eu (PDF-Datei).
- ↑ Haoran Mei; Na Wang; Di Wu; Qi Rong; Xue Bai; Xin Huang; Lina Zhou; Ting Wang; Hongxun Hao: Novel Pharmaceutical Cocrystals of Tegafur: Synthesis, Performance, and Theoretical Studies in Pharm. Res. 41 (2024) 577–593, doi:10.1007/s11095-024-03668-4.
- ↑ Teysuno | European Medicines Agency (EMA). In: ema.europa.eu. 30. März 2011, abgerufen am 1. September 2024 (englisch).
- ↑ Anticancer Agent TS-1 Combination OD Tablets T20, T25 to Be Launched in Japan | 2013 | TAIHO PHARMA. In: taiho.co.jp. 21. Juni 2013, abgerufen am 1. September 2024 (englisch).
Literatur
[Bearbeiten | Quelltext bearbeiten]- H. J. Roth, H. Fenner: Arzneistoffe. Thieme, Stuttgart / New York 1988, ISBN 3-13-673501-3, S. 198–199.

