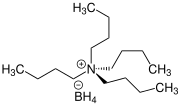
Tetrabutylammoniumborhydrid
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Tetrabutylammoniumborhydrid | ||||||||||||||||||
| Summenformel | C16H40BN | ||||||||||||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 257,31 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Tetrabutylammoniumborhydrid ist ein organisches Komplexsalz, das als Reduktionsmittel beziehungsweise Hydridüberträger reagiert. Es ist eng verwandt mit Natriumborhydrid, im Gegensatz zu diesem aber gut in aprotischen Lösungsmitteln wie Dichlormethan löslich.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Tetrabutylammoniumborhydrid kann durch Salzmetathese aus Tetrabutylammoniumchlorid und Natriumborhydrid hergestellt werden.[3]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Tetrabutylammoniumborhydrid ist ein Feststoff und vergleichsweise stabil: Nach Lagerung bei Raumtemperatur für ein Jahr konnte kein Verlust der Reaktivität festgestellt werden.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Während Natriumborhydrid vor allem in protischen Lösungsmitteln wie Wasser und Alkoholen verwendet wird, ist Tetrabutylammoniumborhydrid gut in weniger polaren Lösungsmitteln wie Dichlormethan löslich, bietet aber eine ähnliche Reaktivität. Es eignet sich für die Reduktion von Aldehyden und Ketonen, sowie Säurechloriden und Estern (wobei letztere bei Raumtemperatur nur langsam umgesetzt werden).[3] Auch Carbonsäuren können durch Tetrabutylammoniumborhydrid reduziert werden.[4]
In chlorierten Lösungsmitteln wie Dichlormethan, Chloroform und Tetrachlorkohlenstoff wird zum Teil Diboran freigesetzt, das sich für die Hydroborierung von Alkenen und Alkinen eignet. Oxidation der gebildeten Verbindungen mit Wasserstoffperoxid ergibt bei Alkenen Alkohole, bei terminalen Alkinen ebenfalls (terminale) Alkohole und bei internen Alkinen Ketone.[5] Besonders leicht kann Diboran gebildet werden, indem Tetrabutylammoniumborhydrid mit Benzylchlorid oder Iod in Toluol umgesetzt wird.[6] Es kann außerdem im Rahmen einer Corey-Bakshi-Shibata-Reduktion verwendet werden, wobei der CBS-Methyl-Katalysator in situ durch Reaktion des Borhydrids mit Diphenylpyrrolidinmethanol und Methyliodid hergestellt wird.[7]
Die Verwendung von Tetrabutylammoniumborhydrid wurde beschrieben bei der Herstellung von Alkyl- und Dialkylferrocenen aus entsprechenden Alkoholen und Ketonen[8], sowie bei der Synthese von Perillenal aus Myrcen.[9]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e Eintrag zu Tetrabutylammonium Borohydride, >96.0% bei TCI Europe, abgerufen am 1. Oktober 2023.
- ↑ a b Dictionary of Analytical Reagents. Taylor & Francis, ISBN 978-0-412-35150-1, S. 1204 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b c Douglas J. Raber, Wayne C. Guida: Tetrabutylammonium borohydride. Borohydride reductions in dichloromethane. In: The Journal of Organic Chemistry. Band 41, Nr. 4, 20. Februar 1976, S. 690–696, doi:10.1021/jo00866a022.
- ↑ S. Narasimhan, S. Swarnalakshmi, R. Balakumar: Reduction of Carboxylic Acids by Tetraalkyl Ammonium Borohydride. In: Synthetic Communications. Band 30, Nr. 5, März 2000, S. 941–946, doi:10.1080/00397910008087107.
- ↑ S. Narasimhan, S. Swarnalakshmi, R. Balakumar: ChemInform Abstract: A Simple Procedure for Hydroboration Using Tetrabutylammonium Borohydride. In: ChemInform. Band 30, Nr. 17, 16. Juni 2010, S. no–no, doi:10.1002/chin.199917066.
- ↑ Mariappan Periasamy, G.P. Muthukumaragopal, Nalluri Sanjeevakumar: A simple and convenient method for the preparation of diborane from tetrabutylammonium borohydride and benzyl chloride for application in organic synthesis. In: Tetrahedron Letters. Band 48, Nr. 39, September 2007, S. 6966–6969, doi:10.1016/j.tetlet.2007.07.173.
- ↑ Shaik Anwar, Mariappan Periasamy: A convenient method for the preparation of oxazaborolidine catalyst in situ using (S)-α,α-diphenylpyrrolidinemethanol, tetrabutylammonium borohydride, and methyl iodide for the asymmetric reduction of prochiral ketones. In: Tetrahedron: Asymmetry. Band 17, Nr. 23, Dezember 2006, S. 3244–3247, doi:10.1016/j.tetasy.2006.11.032.
- ↑ Sukanta Bhattacharyya: Novel Use of Tetrabutylammonium Borohydride in Ionic Hydrogenation: An Expedient, Mild Method for the Preparation of Alkylferrocenes. In: Synlett. Band 1998, Nr. 8, August 1998, S. 837–838, doi:10.1055/s-1998-1812.
- ↑ P. Bæckström, S. Okecha, N. De Silva, D. Wijekoon, T. Norin, Donald Wijekoon, Bengt Ulff: Photooxidation with Simultaneous Reduction of Hydroperoxides with Tetrabutylammonium Borohydride. Synthesis of Perillenal from Myrcene. In: Acta Chemica Scandinavica. 36b, 1982, S. 31–36, doi:10.3891/acta.chem.scand.36b-0031.

