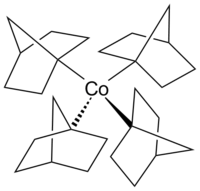
Tetrakis(1-norbornyl)cobalt(IV)
| Strukturformel | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Allgemeines | |||||||
| Name | Tetrakis(1-norbornyl)cobalt(IV) | ||||||
| Andere Namen |
(T-4)-Tetrakis(bicyclo[2.2.1]hept-1-yl)cobalt | ||||||
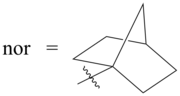
| Summenformel | T4-[Co(nor)4], C28H44Co | ||||||
| Kurzbeschreibung |
braune Kristalle[1] | ||||||
| Externe Identifikatoren/Datenbanken | |||||||
| |||||||
| Eigenschaften | |||||||
| Molare Masse | 439,58 g·mol−1 | ||||||
| Aggregatzustand |
fest | ||||||
| Schmelzpunkt | |||||||
| Löslichkeit | |||||||
| Sicherheitshinweise | |||||||
| |||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||
Tetrakis(1-norbornyl)cobalt(IV) ist eine luftempfindliche, metallorganische Verbindung des Cobalts. Es wurde erstmals von Barton K. Bower und Howard G. Tennent 1972 dargestellt[1] und zählt zu den seltenen Verbindungen, in denen Cobalt die formale Oxidationsstufe +IV zugeschrieben wird.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Tetrakis(1-norbornyl)cobalt(IV) lässt sich durch die Disproportionierung-Reaktion, von CoCl2•THF mit 1-Norbornyllithium (norLi) in n-Pentan, unter Schutzgas gewinnen.[1] Das Cobalt(II)-chlorid-THF-Addukt ist durch Soxhlet-Extraktion von wasserfreiem CoCl2 mit THF und das Lithiumorganyl durch Reaktion von 1-Chloronorbornan mit metallischem Lithium zugänglich.
Die Reinigung erfolgt via Filtration und Umkristallisation.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bei diesem Cobaltkomplex handelt es sich um das erste thermisch stabile, homoleptische Cobalt(IV)tetraorganyl, mit ausschließlich σ-bindenden Liganden. Zudem ist es der erste isolierte low-spin-Komplex mit tetraedrischem Aufbau.[4][5][2]
Stabilität
[Bearbeiten | Quelltext bearbeiten]Die besondere Stabilität ist zu großen Teilen dadurch begründet, dass weder eine α- noch eine β-Hydrid-Eliminierung stattfinden kann. In der α-Position zum Metall (entspricht der 1-Position des Norbornylliganden) ist kein weiterer Wasserstoff gebunden und eine Hydrid-Eliminierung in β-Position würde zu einer energetisch ungünstigen Doppelbindung am Brückenkopfatom führen (Bredtsche Regel). Überdies bewirken die sperrigen Norbornylliganden eine sterische Abschirmung des Zentralatoms und verhindern eine schnelle Ligandensubstitution sowie Homolyse, unter Dimerisierung der Liganden.[1][6]
Die seltene d5-low-spin-Konfiguration im tetraedrischen Ligandenfeld wird dadurch erreicht, dass der Ligand, als sehr starker σ- bzw. genauer n-Elektronenpaardonor, die Aufspaltung der e- und t2-Orbitalsätze in der Weise erhöht, dass die Spinpaarungsenergie überwunden werden kann. Es resultiert eine e4t21-Konfiguration und folgerichtig zeigt eine Magnetmessung Paramagnetismus, in der Größenordnung von einem ungepaarten Elektron auf.[1][5][2]
Cobalt(III)- und Cobalt(V)-Analoga
[Bearbeiten | Quelltext bearbeiten]Ausgehend von CoCl2•THF und 1-Norbornyllithium (norLi), ist ein dreiwertiger Cobaltkomplex darstellbar. Wird anstelle von n-Pentan, ein Gemisch von Diethylether und THF als Lösungsmittel genutzt, kommt es zur Disproportionierung, unter Bildung eines Tetrakis(1-norbornyl)cobaltat(III)-Komplexes, welcher mit solvatisiertem Lithiumgegenion auskristallisiert und elementarem Cobalts.[7][2]
Die Verbindung ist luftempfindlich, zeigt eine grüne Farbe und ist paramagnetisch, im Ausmaß von zwei ungepaarten Elektronen. Folglich liegt auch hier eine low-spin-Konfiguration, bei tetraedrischem Bau vor (d6, e4t22).[7][2]
Wird Tetrakis(1-norbornyl)cobalt(IV) mit Ag[BF4] in THF oxidiert, gelangt man zu einem fünfwertigen Cobaltkomplex, welcher mit einem Tetrafluoroboratanion als Gegenion auskristallisiert.[7][2]
Dieser Komplex ist der erste isolierte, in welchem Cobalt in der Oxidationsstufe +V vorliegt. Auch hier handelt es sich um einen low-spin-Komplex (d4, e4t20).[7][2][4]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f B. K. Bower and H. G. Tennent: Transition metal bicyclo[2.2.1]hept-1-yls. In: J. Am. Chem. Soc. 94. Jahrgang, Nr. 7, 1972, S. 2512–2514, doi:10.1021/ja00762a056.
- ↑ a b c d e f g E. K. Byrne, K. H. Theopold: Synthesis, characterization, and electron-transfer reactivity of norbornyl complexes of cobalt in unusually high oxidation states. In: J. Am. Chem. Soc. 111. Jahrgang, Nr. 11, 1989, S. 3887–3896, doi:10.1021/ja00193a021.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1695.
- ↑ a b E. K. Byrne, D. S. Richeson and K. H. Theopold: Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal. In: J. Chem. Soc., Chem. Commun. Nr. 19, 1986, S. 1491–1492, doi:10.1039/C39860001491.
- ↑ C. Janiak, T. Klapötke, H.-J. Meyer, R. Alsfasser, E. Riedel (Ed.): Moderne Anorganische Chemie, 3. Aufl., De Gruyter, 2007, ISBN 978-3-11-020685-2, S. 718.
- ↑ a b c d E. K. Byrne, K. H. Theopold: Redox chemistry of tetrakis(1-norbornyl)cobalt. Synthesis and characterization of a cobalt(V) alkyl and self-exchange rate of a Co(III)/Co(IV) couple. In: J. Am. Chem. Soc. 109. Jahrgang, Nr. 4, 1987, S. 1282–1283, doi:10.1021/ja00238a066.
![{\displaystyle \mathrm {2\ CoCl_{2}\cdot THF\ +\ 4\ norLi\ {\xrightarrow[{}]{Pentan}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9c7ea9091adcd068e72f316debafc79aa1a6c156)
![{\displaystyle \mathrm {\ \ [Co(nor)_{4}]\ +\ \ Co\ +\ 4\ LiCl\ +} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/71e591bbdfd216ec9771e06c823e0edaf87a6621)

![{\displaystyle \mathrm {3\ CoCl_{2}\cdot THF\ +\ 8\ norLi\ +\ 5\ THF\ {\xrightarrow[{}]{Et_{2}O/THF}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/cab23573b8be7ac95264970ffff9d59e928ba0aa)
![{\displaystyle \mathrm {\ 2\ [Li(THF)_{4}]^{+}[Co(nor)_{4}]^{-}\ +\ Co\ +} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/714d570c5f847df646024eef5838dfee953fce27)

![{\displaystyle \mathrm {[Co(nor)_{4}]\ +\ Ag[BF_{4}]\ {\xrightarrow[{}]{THF}}\ [Co(nor)_{4}]^{+}[BF_{4}]^{-}\ +\ Ag} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/beb2aad3f5219403286f4d4c0a07422ed670e6b2)