Thallium(I)-carbonat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
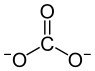
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Thallium(I)-carbonat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Tl2CO3 | |||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 468,78 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Dichte |
7,11 g·cm−3 (25 °C)[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Thallium(I)-carbonat ist eine anorganische chemische Verbindung des Thalliums aus der Gruppe der Carbonate.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Thallium(I)-carbonat kann durch Reaktion einer heißen Thallium(I)-hydroxidlösung mit Kohlendioxid gewonnen werden.[1]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Thallium(I)-carbonat ist ein farbloser Feststoff, der in Form nadelförmiger Kristalle mit scharfem enantiotropem Umwandlungspunkt bei 228 °C vorliegt und löslich in Wasser ist.[1] Es ist das einzige gut in Wasser lösliche Schwermetallcarbonat.[4] Er ist nicht hygroskopisch und an Luft bis 175 °C ohne merkliche Veränderung haltbar. Seine wässrige Lösungen reagieren infolge Hydrolyse stark basisch.[1] Es schmilzt zu einer dunkelgrauen Masse.[5] Die Verbindung besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/m (Raumgruppen-Nr. 12). Bei sehr hohen Drücken wird diese jedoch zerstört.[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Thallium(I)-carbonat kann zur Herstellung künstlicher Diamanten[7] und zum Test auf Kohlenstoffdisulfid[5] verwendet werden.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band 1. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 887.
- ↑ a b c d e f g Datenblatt Thallium(I) carbonate, ≥99.99% trace metals basis bei Sigma-Aldrich, abgerufen am 6. April 2014 (PDF).
- ↑ Nicht explizit in Verordnung (EG) Nr. 1272/2008 (CLP) gelistet, fällt aber mit der angegebenen Kennzeichnung unter den Gruppeneintrag Thalliumverbindungen mit Ausnahme der namentlich in diesem Anhang bezeichneten im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 14. November 2022. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Erwin Riedel, Christoph Janiak: Anorganische Chemie. Walter de Gruyter, 2011, ISBN 3-11-022566-2, S. 615 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Dale L. Perry: Handbook of Inorganic Compounds. CRC Press, 1995, ISBN 0-8493-8671-3, S. 406 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ A. Grzechnik, K. Friese: Crystal structure and stability of Tl2CO3 at high pressures. In: Acta Crystallographica Section C Crystal Structure Communications. 66, 2010, S. i37–i38, doi:10.1107/S0108270110005652.
- ↑ Robert E. Krebs: The History and Use of Our Earth's Chemical Elements: A Reference Guide. Greenwood Publishing Group, 2006, ISBN 0-313-33438-2, S. 188 (eingeschränkte Vorschau in der Google-Buchsuche).



