Tilidin
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||||||||
| 1:1-Gemisch der Stereoisomere: (1S,2R)-Isomer (links) und (1R,2S)-Isomer (rechts) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tilidin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C17H23NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 273,37 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Tilidin ist ein schmerzstillend wirkender Arzneistoff aus der Gruppe der Opioide.
Die synthetisch hergestellte Substanz wird für die Behandlung starker und sehr starker Schmerzen eingesetzt. Als Prodrug hat Tilidin kaum eine schmerzstillende Wirkung und wird erst in der Leber zu den Metaboliten Nortilidin und Bisnortilidin verstoffwechselt, von denen Nortilidin die hauptsächliche Wirkung zeigt.
Um einer missbräuchlichen Anwendung als Rauschmittel vorzubeugen, ist Tilidin in Fertigarzneimitteln meist fix mit dem Arzneistoff Naloxon kombiniert. Die Kombination aus Tilidin und Naloxon soll unter Beibehalten der analgetischen Wirkung das Missbrauchspotenzial vermindern.[5][6] Naloxon wirkt nach oraler Gabe therapeutischer Dosen vernachlässigbar, hebt jedoch nach hohen oralen Dosen oder intravenöser Gabe die Wirkung des Tilidins auf. Für die Behandlung chronischer Schmerzen ist Tilidin als Schmerzmittel in die Stufe 2 gemäß dem WHO-Stufenschema eingeordnet.
Neben Deutschland und der Schweiz ist Tilidin nur in wenigen europäischen Staaten und Südafrika erhältlich.[7] In Österreich ist der Wirkstoff nicht erhältlich.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Tilidin wurde 1967 von Gödecke patentiert[8] und 1970 als Valoron im Markt eingeführt.[9][10] Heutzutage sind auch Generika im Handel, zur Minderung des Missbrauchsrisikos meist als feste Kombination mit Naloxon.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die chemische Synthese von Tilidin geht vom Dimethylaminobuta-1,3-dien, welches aus Crotonaldehyd und Dimethylamin gewonnen wird, und Atropasäureethylester aus, die in einer Diels-Alder-Reaktion die Zielverbindung bilden.

Die Trennung der Diastereomeren kann über chirale Zinkkomplexe erfolgen.[11][12][13]
Stereoisomerie
[Bearbeiten | Quelltext bearbeiten]2-(Dimethylamino)-1-phenylcyclohex-3-en-carbonsäure-ethylester enthält zwei stereogene Zentren. Es existieren also folgende vier Stereoisomere: (1R,2S)-Form und die dazu enantiomere (1S,2R)-Form sowie die (1R,2R)-Form und die (1S,2S)-Form. Der Arzneistoff Tilidin wird als Racemat (1:1-Mischung) aus dem (1R,2S)- und dem (1S,2R)-Enantiomeren eingesetzt.[14] Der Bedeutung der Enantiomerenreinheit der synthetisch hergestellten Arzneistoffe wird zunehmend Beachtung eingeräumt, denn die beiden Enantiomeren eines chiralen Arzneistoffs zeigen fast immer eine unterschiedliche Pharmakologie und Pharmakokinetik. Dies wurde früher aus Unkenntnis über stereochemische Zusammenhänge oft ignoriert.[15] So ist die (1S,2R)-Form [(+)-trans-Form] stärker wirksam, als die (1R,2S)-Form [(−)-trans-Form]. Bei subcutaner Anwendung verhalten sich die ED50-Werte dieser beiden Enantiomere wie 1:23.[16]
Darüber hinaus ist die racemische trans-Form [Tilidin = 1:1-Mischung aus (1R,2S)- und (1S,2R)-Form] etwa zweimal so aktiv wie die in kommerziellen Arzneimitteln nicht eingesetzte racemische cis-Form [1:1-Mischung aus (1R,2R)- und (1S,2S)-Form].[17] Die cis-Form ist bis maximal 0,5 Prozent als Verunreinigung[18] aus dem Syntheseprozess in Tilidin enthalten.
| Übersicht über die Stereoisomere des 2-Dimethylamino-1-phenylcyclohex-3-encarbonsäureethylesters | ||||
| Isomere Form | (1S,2R)-trans | (1R,2S)-trans | (1R,2R)-cis | (1S,2S)-cis |
| Strukturformel | 
|
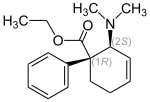
|

|
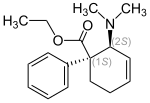
|
| Namen | Dextilidin (INN) (+)-trans-Tilidin, (+)-Tilidin, (1S,2R)-trans-Tilidin |
(−)-trans-Tilidin, (−)-Tilidin, (1R,2S)-trans-Tilidin |
cis-Tilidin (INNvm) | |
| Tilidin (INNv) trans-Tilidin, (±)-trans-Tilidin, D,L-trans-Tilidin, Tilidate (BAN 1999), rac-Ethyl[(1RS,2SR)-2-(dimethylamino)-1-phenylcyclohex-3-encarboxylat] | ||||
| Ethyl[2-(dimethylamino)-1-phenylcyclohex-3-encarboxylat] | ||||
| CAS-Nummer | 32447-90-8 | 38690-93-6 | 20380-56-7 (Racemat cis-Form) | |
| 51931-66-9 (Racemat trans-Form) | ||||
| 17243-69-5 (nicht spezifiziert / Isomerengemisch) | ||||
| Datenbank-Links |
PubChem: 30131 |
PubChem:12546498 |
PubChem: 44150542 | |
|
PubChem: 98526 | ||||
|
PubChem: 32329 | ||||
Pharmazeutische Informationen
[Bearbeiten | Quelltext bearbeiten]Tilidin wird arzneilich in Form des Hydrochlorid-Hemihydrats und des Phosphats verwendet. Als Darreichungsformen gibt es Tropfen (20 Tropfen = 50 mg) zum Einnehmen und Retardtabletten (50–200 mg). In Deutschland ist Tilidin in den Präparaten mit Naloxon kombiniert (pro 50 mg Tilidin je 4 mg Naloxon).
Klinische Angaben
[Bearbeiten | Quelltext bearbeiten]Anwendungsgebiete
[Bearbeiten | Quelltext bearbeiten]Tilidin ist angezeigt zur Behandlung starker und sehr starker Schmerzen. Die Potenz liegt bei 0,16–0,19 im Vergleich zu Morphin (etwa ein Sechstel bis ein Fünftel der schmerzstillenden Wirkstärke)[19] – nach anderen Angaben[20] beträgt die analgetische Äquivalenz der Einzeldosis nur 0,1 (ein Zehntel).
Nebenwirkungen
[Bearbeiten | Quelltext bearbeiten]Prinzipiell treffen alle der opioidtypischen Nebenwirkungen auf Tilidin zu (siehe Opioide, Abschnitt „Weitere Wirkungen“). Allerdings kann wegen des Naloxon-Zusatzes die Verstopfung (Obstipation) deutlich schwächer ausgeprägt sein. Auch vermindert Naloxon die atemdepressive Wirkung.[21] Der rasche Wirkungseintritt begünstigt Übelkeit und Erbrechen.
Anwendung bei eingeschränkter Leber- und Nierenfunktion
[Bearbeiten | Quelltext bearbeiten]Bei Patienten mit bestehenden Vorschädigungen der Leber besteht die Gefahr eines Wirkungsverlustes, da die hepatische Metabolisierung zu den wirksamen Metaboliten beeinträchtigt werden kann. Eine Niereninsuffizienz erfordert keine Dosisanpassung.
Gegenanzeigen
[Bearbeiten | Quelltext bearbeiten]Tilidin ist kontraindiziert bei Überempfindlichkeit gegen die Substanz, bei Opiatabhängigkeit (siehe Abschnitt Pharmakologie), Porphyrie, Atemdepression, Darmverschluss, akutem Abdomen, Schädel-Hirn-Trauma, erhöhtem intrakraniellen Druck und in Kombination mit bestimmten Medikamenten (Benzodiazepine oder MAO-Hemmer).
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Tilidin an sich hat kaum opioidtypische Wirkung und wird erst bei seiner ersten Passage durch die Leber durch Demethylierung zu Nortilidin – dem eigentlichen opioiden Wirkstoff – verstoffwechselt. Nortilidin ist einerseits ein µ-Agonist, andererseits wird es im weiteren Verlauf in das wiederum aktive Bisnortilidin überführt, das ebenfalls opioide Effekte vermittelt. Nach der Einnahme von Tilidin baut sich die Opioidwirkung vergleichsweise schnell auf (etwa 10–20 Minuten). Die Enzyme, die an diesem Schritt beteiligt sind, gehören zur Klasse der Cytochrom P450. Im Detail scheinen die zu dieser Klasse gehörenden Enzyme CYP3A4 und CYP2C19 am Abbau von Tilidin zu Nortilidin und gleichfalls am weiteren Abbau zu Bisnortilidin und bisher nicht weiter untersuchter polarer Substanzen beteiligt zu sein. Dies konnte durch Inhibition mit Naloxon und spezifisch diese Enzyme hemmende Antagonisten nachgewiesen werden. Dabei werden zwei Drittel der Dosis von Tilidin zu Nortilidin verstoffwechselt, wovon durch Demethylierung die Hälfte weiter zu Bisnortilidin verstoffwechselt wird. Damit stehen ca. 33 % an der wirksamen Form Nortilidin zur Verfügung.[22]
In den üblichen Dosierungen, die patientenabhängig schwanken können, setzt die analgetische Wirkung nach etwa 5 bis 10 Minuten (Injektion, Tropfen zum Einnehmen) bzw. etwa 15 bis 20 Minuten (Kapseln) ein, die Wirkdauer beträgt ungefähr 4 bis 6 Stunden.[23] Bei Retardarzneimitteln, also Darreichungsformen, die den Wirkstoff nach und nach abgeben, ist die Wirkdauer mit 6 bis 12 Stunden[20] entsprechend länger. Der analgetisch aktive Metabolit Nortilidin hat eine terminale Plasmahalbwertszeit von 3 bis 5 Stunden.[23]
Das dem Tilidin beigegebene Naloxon wird nach oraler Gabe therapeutischer Dosen bei seiner ersten Passage durch die Leber fast vollständig abgebaut und inaktiviert (First-Pass-Effekt). Nur nach Einnahme großer Mengen oder nach parenteraler Gabe verbleiben ausreichende Konzentrationen von Naloxon, um eine antagonistische Wirkung zu entfalten und die Wirkung des eingenommenen Tilidins zu hemmen oder zunichtezumachen. Bei Opiatabhängigen kann es auch bei oraler Gabe zu schwersten Entzugserscheinungen kommen.
Tilidin hat keine antitussive Wirkung.[24]
Verwendung als Rauschmittel
[Bearbeiten | Quelltext bearbeiten]Die Verwendung von Tilidin als Rauschmittel wird dadurch eingeschränkt, dass es in der Regel mit Naloxon, einem Opioidantagonisten, fix kombiniert ist und nicht retardierte Präparate sowie Monopräparate nur auf Betäubungsmittelrezept zu beziehen sind. In Deutschland kommen auf alle Fertigarzneimittel pro 50 mg Tilidin je 4 mg Naloxon hinzu.
Unter Konsumenten hochpotenter Opiate wie Morphin, halbsynthetischer Opioide wie Diamorphin (Heroin) oder vollsynthetischer Opioide wie Methadon ist Tilidin wenig verbreitet. Presseberichten zufolge kommt es im Zusammenhang mit Tilidin jedoch vergleichsweise häufig zu Rezeptfälschungen.[25]
Das funk-Format STRG F veröffentlichte 2020 eine Dokumentation über den Missbrauch von Tilidin als Rauschdroge.[26] Als ein Grund eines erhöhten Konsums unter Jugendlichen wird in der ARD-Recherche die gleichzeitige Popularität von Deutschrappern genannt, die in ihren Rap-Songs Tilidin thematisieren. Allerdings wurde die zunächst im Video thematisierte Behauptung, dass Verschreibungen unter Jugendlichen um das 30-fache zugenommen hätten, später als Falschmeldung aufgrund von Rechenfehlern identifiziert. Dennoch gab es einen etwa 50-prozentigen Anstieg der Verschreibungen unter 15–20-Jährigen.
Auch aufgrund der medialen Konzeption und Missbrauchsaffinität, wie sie auch durch Populärkultur unterstrichen wird, hat Tilidin ein vergleichsweise schlechtes Image.[27]
Betäubungsmittelrechtliche Vorschriften
[Bearbeiten | Quelltext bearbeiten]Tilidin unterliegt betäubungsmittelrechtlichen Vorschriften. In Deutschland darf trans-Tilidin als verkehrs- und verschreibungsfähiges Betäubungsmittel[28] seit dem 1. Januar 2013 nur noch auf einem Betäubungsmittelrezept verordnet werden.[29] Ausgenommen sind feste Zubereitungen mit verzögerter Wirkstofffreigabe (Retardarzneimittel), die den Wirkstoff unterhalb einer festgelegten Dosisgrenze und in Kombination mit Naloxon enthalten.[30] cis-Tilidin ist verkehrs-, aber nicht verschreibungsfähig.[31]
In den USA unterliegt Tilidin der Schedule-I; die Substanzen dieser Kategorie (unter anderem etwa Heroin und Cannabis[32]) sind vergleichbar mit den Substanzen des BtMG der Anlage-I. Demnach wird für das Schmerzmittel Tilidin in den USA kein medizinischer Nutzen anerkannt und es ist verboten.[33]
Handelsnamen
[Bearbeiten | Quelltext bearbeiten]- Kombinationspräparate
- Valoron N (D), Valtran (B), zahlreiche Generika (D)
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 1622.
- ↑ Registrierungsdossier zu Ethyl 2-(dimethylamino)-1-phenylcyclohex-3-ene-1-carboxylate (Abschnitt GHS) bei der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. Januar 2020.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Ethyl 2-(dimethylamino)-1-phenylcyclohex-3-ene-1-carboxylate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. Januar 2020.
- ↑ a b c Gödecke, Berlin / Freiburg im Breisgau, 1974.
- ↑ E. Mutschler, G. Geisslinger, H. K. Kroemer, S. Menzel, P. Ruth: Mutschler Arzneimittelwirkungen. Pharmakologie − Klinische Pharmakologie − Toxikologie. 10. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2012. S. 225.
- ↑ Fachinformationen Valoron N retard Retardtabletten, Valoron N Tropfen (Pfizer Pharma PFE). Stand Juli 2017.
- ↑ Tilidine. Abgerufen am 2. Januar 2023 (englisch).
- ↑ Römpp Lexikon Chemie. 10. Auflage. Georg Thieme-Verlag, Stuttgart / New York 1999, S. 4556.
- ↑ U. Pommer: Sucht auf Rezept. In: Zeit, 15. April 1977.
- ↑ M. Herrmann: Zum Wirkungsprinzip der Kombination Tilidin plus Naloxon. In: Biologie der Sucht. Suchtproblematik. Springer, Berlin, Heidelberg, 1985. doi:10.1007/978-3-642-82542-2_14
- ↑ G. Satzinger: Über Cyclohexene, I Synthese und Reaktionen von 4-Phenyl-3-amino-cyclohexenen-(1), einer neuen Klasse von Analgetica. In: Justus Liebigs Annalen der Chemie. 758, 1969, S. 64–87, doi:10.1002/jlac.19697280111.
- ↑ G. Satzinger: Über Cyclohexene, II Struktur und Eigenschaften der stereoisomeren 3-Dimethylamino-4-phenyl-4-ethoxycarbonyl-1-cyclohexene. In: Justus Liebigs Annalen der Chemie. 758, 1972, S. 43–64, doi:10.1002/jlac.19727580105.
- ↑ G. Satzinger: Über Cyclohexene, III Die absolute Konfiguration von (+)- und (−)-3r-Dimethylamino-4c-phenyl-4t-äthoxycarbonyl-1-cyclohexen. In: Justus Liebigs Annalen der Chemie. 758, 1972, S. 65–67, doi:10.1002/jlac.19727580106.
- ↑ Europäisches Arzneibuch. 6. Ausgabe. Deutscher Apotheker-Verlag, Stuttgart 2008, ISBN 978-3-7692-3962-1, S. 4160–4161.
- ↑ E. J. Ariëns: Stereochemistry, a basis for sophisticated nonsense in pharmacokinetics and clinical pharmacology. In: European Journal of Clinical Pharmacology. 26, 1984, S. 663–668, doi:10.1007/BF00541922.
- ↑ Hermann J. Roth, Christa E. Müller, Gerd Folkers: Stereochemie und Arzneistoffe. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1998, ISBN 3-8047-1485-4, S. 251–274.
- ↑ Hermann J. Roth, Christa E. Müller, Gerd Folkers: Stereochemie und Arzneistoffe. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1998, ISBN 3-8047-1485-4, S. 120.
- ↑ European Pharmacopoea, Edition 9.0, European Directorate for the Quality of Medicines & HealthCare; 2018, S. 3788, Monografie Tilidine hydrochloride hemihydrate.
- ↑ Hagers Handbuch der pharmazeutischen Praxis. Band 9, Springer Verlag, 1995, S. 934.
- ↑ a b Eberhard Klaschik: Schmerztherapie und Symptomkontrolle in der Palliativmedizin. In: Stein Husebø, Eberhard Klaschik (Hrsg.): Palliativmedizin. 5. Auflage, Springer, Heidelberg 2009, ISBN 3-642-01548-4, S. 207–313, hier: S. 234.
- ↑ J. Sorge: Medikamentöse Schmerztherapie - Opioide. In: M. Zenz, I. Jurna: Lehrbuch der Schmerztherapie. Stuttgart 2001, S. 462.
- ↑ J. Weiss, E. Sawa, K.-D. Riedel, W. E. Haefeli, G. Mikus: In vitro metabolism of the opioid tilidine and interaction of tilidine and nortilidine with CYP3A4, CYP2C19, and CYP2D6. In: Naunyn-Schmiedeberg’s Arch. Pharmacol. 378, 2008, S. 275–282, doi:10.1007/s00210-008-0294-7.
- ↑ a b K. Hardtke u. a. (Hrsg.): Kommentar zum Europäischen Arzneibuch. Ph. Eur. 7.0, Tilidinhydrochlorid-Hemihydrat. Loseblattsammlung, 39. Lieferung 2011, Wissenschaftliche Verlagsgesellschaft, Stuttgart.
- ↑ K. Aktories, U. Förstermann, F. B. Hofmann, K. Starke: Allgemeine und spezielle Pharmakologie und Toxikologie, 9. Auflage. Urban & Fischer in Elsevier, 2006, ISBN 3-437-44490-5.
- ↑ Berlin will schärfer gegen Modedroge Tilidin vorgehen. In: Der Spiegel. 11. August 2008, S. 131.
- ↑ Tilidin: Wie läuft das Geschäft mit dem Schmerzmedikament? In: STRG F. YouTube, 1. September 2020, abgerufen am 9. September 2020.
- ↑ Schmerzmedikament Tilidin: Experten warnen vor Missbrauch. In: tagesschau.de. Abgerufen am 9. September 2020.
- ↑ gesetze-im-internet.de: Anlage III (zu § 1 Abs. 1) verkehrsfähige und verschreibungsfähige Betäubungsmittel zum Betäubungsmittelgesetz.
- ↑ Schnellfreisetzendes Tilidin bald BtM-pflichtig. In: pharmazeutische-zeitung.de. 1. Januar 2013, abgerufen am 13. April 2015.
- ↑ „…ausgenommen in festen Zubereitungen mit verzögerter Wirkstofffreigabe, die ohne einen weiteren Stoff der Anlagen I bis III je abgeteilte Form bis zu 300 mg Tilidin, berechnet als Base, und, bezogen auf diese Menge, mindestens 7,5 vom Hundert Naloxonhydrochlorid enthalten“, Quelle: gesetze-im-internet.de: Anlage III (zu § 1 Abs. 1) verkehrsfähige und verschreibungsfähige Betäubungsmittel zum Betäubungsmittelgesetz.
- ↑ Anlage II (zu § 1 Abs. 1) verkehrsfähige, aber nicht verschreibungsfähige Betäubungsmittel, gesetze-im-internet.de
- ↑ Nadia Kounang CNN: Kratom to join heroin, LSD on Schedule I drug list. Abgerufen am 27. März 2017.
- ↑ U.S. DEA (US-Drogenbekämpfungsbehörde): Drug Scheduling ( des vom 29. Januar 2012 auf WebCite) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ATC-N02
- Gesundheitsschädlicher Stoff bei Verschlucken
- Augenreizender Stoff
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Cyclohexen
- Dimethylamin
- Phenylsubstituierte Verbindung
- Opioid
- Arzneistoff
- Betäubungsmittel (BtMG Anlage III)
- Psychotropes Opioid
- Psychotroper Wirkstoff
- Synthetische psychotrope Substanz
- Carbonsäureethylester