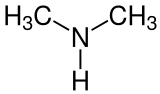
Dimethylamin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dimethylamin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C2H7N | ||||||||||||||||||
| Kurzbeschreibung |
farbloses Gas mit fisch- bzw. ammoniakartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 45,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig[1] | ||||||||||||||||||
| Dichte |
0,67 g·cm−3 (beim Siedepunkt v. 7 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
7 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| pKS-Wert |
10,73 (25 °C, konjugierte Säure)[2] | ||||||||||||||||||
| Löslichkeit |
| ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−18,8 kJ/mol[6] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Dimethylamin (nach IUPAC-Nomenklatur: N-Methylmethanamin, abgekürzt auch als DMA bezeichnet) ist eine organisch-chemische Verbindung aus der Stoffgruppe der sekundären aliphatischen Amine. Es kommt als 40%ige wässrige Lösung, 33%ige Lösung in Ethanol und als druckverflüssigtes Gas in den Handel.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Zur großtechnischen Synthese von Dimethylamin setzt man Methanol mit Ammoniak bei Temperaturen von 350–450 °C und Drücken von 15–25 bar in Gegenwart von Aluminiumoxid (-silicat oder -phosphat) in Rohrreaktoren stufenweise um. Im ersten Schritt reagiert Methanol mit Ammoniak zu Methylamin. Dieses reagiert im Anschluss mit einem weiteren Äquivalent Methanol und bildet so Dimethylamin.[7][8]

Als Nebenprodukte werden neben Wasser auch noch Methylamin und Trimethylamin gebildet, die durch mehrstufige Druck- sowie Extraktivdestillation abgetrennt werden müssen. Dabei kann das abgetrennte Methylamin separat in einem weiteren Reaktor mit Methanol zum Dimethylamin umgesetzt werden. Das Gewichtsverhältnis von Mono-, Di- und Trimethylamin bei dieser Reaktion beträgt ca. 20:20:60.[7]
Die Produktionskapazität für Methylamine betrug 1996 weltweit ungefähr 830.000 Jahrestonnen.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Physikalische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Dimethylamin hat eine relative Gasdichte von 1,60 (Dichteverhältnis zu trockener Luft bei gleicher Temperatur und gleichem Druck) und eine Gasdichte von 2,013 kg·m−3 bei Normbedingungen (0 °C, 1013 mbar). Die Dichte der flüssigen Phase am Siedepunkt beträgt 0,6703 g·cm−3, die Gasdichte bei einer Temperatur von 15 °C und einem Druck von 1 bar beträgt 1,9426 kg·m−3. Außerdem weist Dimethylamin einen Dampfdruck von 1703 hPa bei 20 °C und 4596 hPa bei 52 °C auf. Der Tripelpunkt ist mit −92,2 °C gleich der Schmelztemperatur. Die kritische Temperatur beträgt 164,6 °C, der kritische Druck 53,1 bar und die kritische Dichte 0,256 g·cm−3.[1]
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Dimethylamin ist ein extrem entzündliches Gas aus der Stoffgruppe der sekundären Amine. Es bildet mit Luft explosive Gemische. In Wasser löst es sich unter Hydrolyse gut, wobei die wässrigen Lösungen stark alkalisch reagieren (pKB 3,29). Dimethylamin ist schwerer als Luft. Meistens liegt es in Druckgasflaschen in verflüssigter Form vor und ist daneben als 40%ige wässrige Lösung und 33%ige Lösung in Ethanol kommerziell verfügbar. Präparativ vorteilhaft ist der Einsatz des leicht zugänglichen Dimethylamin-Kohlenstoffdioxid-Komplexes[9]. Durch Umsetzung mit Alkylierungsmitteln, Alkylenoxiden, Carbonylverbindungen, organischen Säuren usw. kann Dimethylamin zu zahlreichen Folgeverbindungen umgesetzt werden. Bei Reaktion mit nitrosierenden Agenzien (z. B. Nitriten, salpetriger Säure, nitrosen Gasen) kann es zur Bildung von krebserzeugenden Nitrosaminen kommen.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Im Labor wird Dimethylamin zur Einführung einer Dimethylamino-Gruppe in andere organische Verbindungen verwendet. In der chemischen und weiterverarbeitenden Industrie findet es auch als Stabilisator für Latices, Lösungsmittel, Enthaarungsmittel bei der Lederherstellung und als Gasabsorptionsmittel Anwendung. Des Weiteren wird es zur Herstellung von Vulkanisationsbeschleunigern, Fungiziden, Herbiziden, Flotationschemikalien, Antioxidantien, Raketentreibstoffen, quartären Ammoniumsalzen, Wasch- und Reinigungsmitteln und Pharmazeutika verwendet. Bedeutend ist auch die großtechnische Weiterverarbeitung zu Dimethylformamid (DMF) und N,N-Dimethylglycin.[3]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Dimethylamin ist ein extrem entzündbares Gas, welches mit Luft explosive Gemische bildet. Bei hohen Konzentrationen besteht zudem Erstickungsgefahr. Hauptsächlich wird Dimethylamin über die Atemwege und die Haut aufgenommen. Dabei kommt es akut zu irritativen bis ätzenden Wirkungen auf Schleimhäute, Augen, Atemwege und die Haut. Außerdem wurde eine schwach ausgeprägte zentralnervöse Wirkungsweise festgestellt. Chronisch treten bei dem Betroffenen Störungen im Zentralnervensystem sowie ein allgemeines Unwohlsein auf. Zur Reproduktionstoxizität sind keine ausreichenden Angaben bekannt. Dimethylamin alleine stellte sich als nicht muta- oder kanzerogen heraus, lediglich die hochgiftigen Folgeverbindungen wie Nitrosamine zeigen ein erhöhtes krebserzeugendes und genveränderndes Potential. Dimethylamin weist eine untere Explosionsgrenze von ca. 2,80 Vol.-% bei 52 g/cm3 und eine obere Explosionsgrenze von ca. 14,4 Vol.-% bei 270 g/cm3 auf. Die Zündtemperatur beträgt ca. 400 °C. Der Stoff fällt somit in die Temperaturklasse T2 und die Explosionsgruppe IIA. Die Grenzspaltweite wurde auf 1,15 mm ermittelt. Mit einem Flammpunkt von −55 °C gilt Dimethylamin als extrem leicht entflammbar.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n o Eintrag zu Dimethylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 6. März 2019. (JavaScript erforderlich)
- ↑ W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Dissociation Constants of Organic Acids and Bases, S. 5-91.
- ↑ a b Eintrag zu Dimethylamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 6. März 2019.
- ↑ Eintrag zu Dimethylamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 6. März 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte, abgerufen am 25. August 2019.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-23.
- ↑ a b Patent EP1931466B1: Formkörper enthaltend ein Alumosilikat und Aluminiumoxid und Verfahren zur kontinuierlichen Herstellung von Methylaminen. Angemeldet am 21. September 2006, veröffentlicht am 14. November 2012, Anmelder: BASF SE, Erfinder: Marco Bosch et al.
- ↑ a b Hans-Jürgen Arpe: Industrielle Organische Chemie - Bedeutende Vor- und Zwischenprodukte. 6. Auflage. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim 2007, ISBN 978-3-527-31540-6, S. 55.
- ↑ Werner Schroth, Jörg Andersch, Hans-Dieter Schädler, Roland Spitzner: Der Dimethylamin-Kohlendioxid-Komplex DIMCARB und seine präparative Verwendung. In: Chemiker-Zeitung. Band 113, 1989, S. 261–271.



