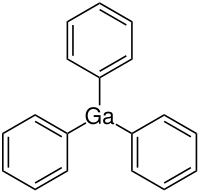
Triphenylgallium
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||
| Raumgruppe |
Pbcn (Nr. 60)[1] | ||||||||||||
| Gitterparameter |
a = 1836 pm, b = 1062 pm, c = 743 pm[1] | ||||||||||||
| Allgemeines | |||||||||||||
| Name | Triphenylgallium | ||||||||||||
| Summenformel | C18H15Ga | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 301,0 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest[1] | ||||||||||||
| Dichte |
1,38 g·cm−3[1] | ||||||||||||
| Schmelzpunkt | |||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Triphenylgallium ist eine metallorganische Galliumverbindung.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Triphenylgallium kann durch Reaktion von Diphenylquecksilber mit Gallium oder durch Reaktion von Gallium(III)-chlorid mit Phenyllithium gewonnen werden.[3][4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Triphenylgallium ist ein luft- und feuchtigkeitsempfindlicher Feststoff.[3] Er besitzt eine orthorhombische Kristallstruktur mit der Raumgruppe Pbcn (Raumgruppen-Nr. 60).[1] Das Molekül ist nicht planar, sondern durch das freie Elektronenpaar pyramidal.[1] Die Verbindung ist in Lösung monomer, aber seine Kristalle bilden aufgrund schwacher intermolekularer Wechselwirkungen Kettenstrukturen.[5]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Triphenylgallium wird als Katalysator für die Polymerisation von Alkenen verwendet.[4] Es reagiert mit Benzaldehyd zu Benzhydrol und langsam mit Benzoylchlorid zu Benzophenon.[6][3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g J. F. Malone, W. S. McDonald: Crystal structures of triphenylgallium and triphenylindium. In: Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 1970, S. 3362–3367, doi:10.1039/j19700003362.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b c Henry Gilman, R. G. Jones: Triphenylgallium 1. In: Journal of the American Chemical Society. Band 62, Nr. 4, 1940, S. 980–982, doi:10.1021/ja01861a075.
- ↑ a b Dictionary of Organometallic Compounds. Taylor & Francis, ISBN 978-0-412-43060-2, S. 1686 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ K. Wade, A. J. Banister: The Chemistry of Aluminium, Gallium, Indium and Thallium. Elsevier Science, 2016, ISBN 978-1-4831-5322-3, S. 1114 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ E. H. Rodd, Samuel Coffey: Rodd's Chemistry of Carbon Compounds. Elsevier Publishing Company, 1964, ISBN 0-444-41092-9, S. 331 (eingeschränkte Vorschau in der Google-Buchsuche).