Triphenylmethylradikal
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
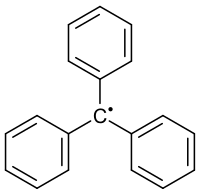
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Triphenylmethylradikal | ||||||||||||
| Andere Namen |
Tritylradikal | ||||||||||||
| Summenformel | C19H15 | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 243,33 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Das Triphenylmethylradikal (oft abgekürzt als trityl radical) ist ein stabilisiertes Radikal und das erste Radikal, das in der organischen Chemie beschrieben wurde. Es kann durch Homolyse von Triphenylmethylchlorid 1 durch ein geeignetes Metall wie Silber oder Zink in Benzol oder Diethylether gewonnen werden. Das Radikal 2 steht dabei im chemischen Gleichgewicht zum chinonartigen Dimer 3 (3-Triphenylmethyl-6-diphenylmethyliden-1,4-cyclohexadien, auch als Gombergs Dimer bezeichnet). In Benzol liegt die Konzentration des Radikals dabei bei 2 %.[2]
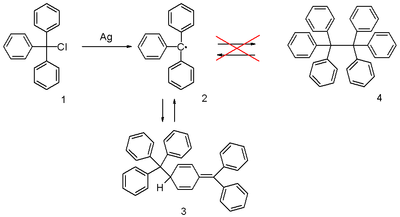
Lösungen des Radikals sind gelb, wobei die Farbe bei zunehmender Temperatur an Intensität zunimmt. Dies ist in Übereinstimmung mit dem Prinzip von Le Chatelier auf eine Gleichtgewichtsverschiebung auf die Seite des Radikals zurückzuführen.
Wird das Triphenylmethylradikal Luft ausgesetzt oxidiert es schnell zum Peroxid und entsprechende Lösungen entfärben sich.
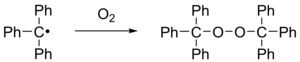
Mit Iod reagiert es zu Triphenylmethyliodid.
Entdeckt wurde das Radikal 1900 von Moses Gomberg an der University of Michigan.[3][4][5] Er hatte versucht, Hexaphenylethan mittels einer Wurtzschen Synthese aus Triphenylmethylchlorid und Zink in Benzol zu synthetisieren. Dabei stellte er fest, dass das erhaltene Produkt eine deutlich höhere Reaktivität gegenüber Sauerstoff und Iod aufwies als erwartet. Die so entdeckte Struktur wurde später in der Entwicklung der ESR-Spektroskopie genutzt und konnte durch diese bestätigt werden.[6][7][8]
Die richtige, chinonartige Struktur wurde bereits 1904 ein erstes Mal vorgeschlagen, allerdings von der Allgemeinheit der Chemiker gegenüber Hexaphenylethan 4 abgelehnt.[9] Daraufhin dauerte es bis 1968, bis sie durch von Forschern an der Vrijen Universiteit Amsterdam durch NMR-spektroskopische Experimente wiederentdeckt und bestätigt wurde.[10]
Während das Triphenylmethylradikal ein chinoinartiges Dimer bildet, konnte für unterschiedlich substituierte Derivate eine Dimer mit einer hexaphenylethanartigen Struktur nachgewiesen werden. Röntgenkristallographische Untersuchungen zeigten bei Hexakis(3,5-di-t-butylphenyl)ethan für die zentrale C–C-Bindung eine Länge von 1,67 Å. Diese ist im Vergleich zu einer typischen Einfachbindung mit 1,54 Å sehr lang. Theoretische Berechnungen auf einem hohen Niveau deuten darauf hin, dass der Grund für die Stabilität dieses sterisch gehinderten Moleküls an London-Dispersionswechselwirkungen zwischen den tert-Butylsubstituenten liegt. Das dadurch erzeugte Potentialminimum fehlt beim unsubstituierten Molekül.[11][12] Derivate mit anderen Substitutionsmustern wurden in Form des chinonartigen Dimers gefunden.[13]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ J. March: Advanced Organic Chemistry. John Wiley & Sons, 1985, ISBN 0-471-88841-9.
- ↑ M. Gomberg: An instance of trivalent carbon: triphenylmethyl. In: Journal of the American Chemical Society. 22. Jahrgang, Nr. 11, 1900, S. 757–771, doi:10.1021/ja02049a006 (zenodo.org [PDF]).
- ↑ M. Gomberg: On trivalent carbon. In: Journal of the American Chemical Society. 23. Jahrgang, Nr. 7, 1901, S. 496–502, doi:10.1021/ja02033a015. (Anmerkung: Radikal wird auch als cadicle bezeichnet.)
- ↑ M. Gomberg: On trivalent carbon. In: Journal of the American Chemical Society. 24. Jahrgang, Nr. 7, 1902, S. 597–628, doi:10.1021/ja02021a001 (zenodo.org).
- ↑ S. I. Weissman, John C. Sowden: Electron distribution in triphenylmethyl: Hyperfine structure of the paramagnetic resonance absorption of (C6H5)3C13*. In: Journal of the American Chemical Society. 75. Jahrgang, Nr. 2, 1953, S. 503, doi:10.1021/ja01098a522.
- ↑ J. Sinclair, D. Kivelson: Electron spin resonance studies of substituted triphenylmethyl radicals. In: Journal of the American Chemical Society. 90. Jahrgang, Nr. 19, 1968, S. 5074–5080, doi:10.1021/ja01021a004.
- ↑ ESR spectrum of the triphenylmethyl radical. School of Chemistry, University of Bristol, abgerufen am 5. August 2018.
- ↑ J. M. McBride: The hexaphenylethane riddle. In: Tetrahedron. 30. Jahrgang, Nr. 14, 1974, S. 2009–2022, doi:10.1016/S0040-4020(01)97332-6.
- ↑ H. Lankamp, W. Th. Nauta, C. MacLean: A new interpretation of the monomer–dimer equilibrium of triphenylmethyl- and alkyl-substituted-diphenyl methyl-radicals in solution. In: Tetrahedron Letters. 9. Jahrgang, Nr. 2, 1968, S. 249–254, doi:10.1016/S0040-4039(00)75598-5.
- ↑ Errol G Lewars: Hexaphenylethane. In: Modeling Marvels. Springer Netherlands, Dordrecht 2008, ISBN 978-1-4020-6972-7, S. 115–129, doi:10.1007/978-1-4020-6973-4_8 (springer.com [abgerufen am 25. September 2019]).
- ↑ Stefan Grimme, Peter R. Schreiner: Steric crowding can stabilize a labile molecule: Solving the hexaphenylethane riddle. In: Angewandte Chemie International Edition. 50. Jahrgang, Nr. 52, 2011, S. 12639–12642, doi:10.1002/anie.201103615.
- ↑ Y. Uchimura, T. Takeda, R. Katoono, K. Fujiwara, T. Suzuki: New Insights into the Hexaphenylethane Riddle: Formation of an α,o-Dimer. In: Angewandte Chemie International Edition. 54. Jahrgang, Nr. 13, 2015, S. 4010–4013, doi:10.1002/anie.201500122.