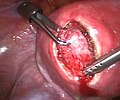
Hysterektomie
Als Hysterektomie (von altgriechisch ὑστέρα hystéra ‚Gebärmutter, Mutterleib‘, etymologisch verwandt mit lateinisch uterus und „Hysterie“, sowie ἐκτομή ektomē ‚Abschneiden, Ausschneiden‘)[1] bezeichnet man die operative Entfernung der Gebärmutter. Synonym ist die Bezeichnung Uterusexstirpation (von lateinisch uterus ‚Gebärmutter‘ und exstirpare ‚ausreißen‘, ‚beseitigen‘). Werden zusätzlich die Eileiter und die Eierstöcke entfernt, wird der Eingriff als Hysterektomie (mit ein- oder beidseitiger) Adnektomie (oder Adnexektomie) bezeichnet. In der Veterinärmedizin werden reine Hysterektomien praktisch nie durchgeführt, weil sie häufig zu schweren Komplikationen führen. Hier kommt meist eine Ovariohysterektomie zum Einsatz.
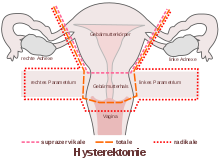
Der Begriff der Totalexstirpation grenzt dabei die vollständige Entfernung der Gebärmutter (totale Uterusexstirpation, früher auch Uterusamputation) gegen die subtotale oder auch suprazervikale Uterusexstirpation ab, bei welcher der Gebärmutterhals (Zervix) erhalten bleibt. Oft wird die vollständige Entfernung der Gebärmutter auch als Totaloperation bezeichnet. Der Begriff ist jedoch hinsichtlich des Ausmaßes der Hysterektomie nicht klar definiert, daher missverständlich, und sollte vermieden werden.[2][3]
In der Gynäkologie ist die Hysterektomie ein häufiger Eingriff, der etwa beim Uteruskarzinom, aber überwiegend bei gutartigen Uteruserkrankungen durchgeführt wird.
Indikationen
[Bearbeiten | Quelltext bearbeiten]
Eine Entfernung der Gebärmutter wird aus vielen verschiedenen Gründen durchgeführt. Dabei stellen gutartige Erkrankungen, wie gutartige Tumoren, und funktionelle Erkrankungen, wie schwerwiegende Menstruationsunregelmäßigkeiten, 90 Prozent der Indikationen für eine Hysterektomie dar.[4][5][6] Insgesamt sind in 38,7 Prozent aller Hysterektomien ein Uterus myomatosus, in 17,1 Prozent eine Endometriose und in 14,5 Prozent ein Uterusprolaps der Grund für eine solche Operation.
9,4 Prozent der Hysterektomien erfolgten bis 2008 wegen einer bösartigen Erkrankung, wie einem Karzinom des Gebärmutterhalses, des Gebärmutterkörpers oder der Eierstöcke. Veränderungen der Gebärmutterschleimhaut waren bei drei Prozent der Patientinnen Grund für die Operation.[7]
Außerdem kann eine Hysterektomie bei schweren Verletzungen oder Entzündungen der Gebärmutter und im Falle unstillbarer Blutungen nach einer Geburt erforderlich sein.[8][9][10]
In Deutschland war bis 2011 für eine Personenstandsänderung im Rahmen einer Geschlechtsangleichung bei „Frau-zu-Mann Transsexuellen“ eine Hysterektomie Voraussetzung, um die durch das Transsexuellengesetz geforderte dauerhafte Unfruchtbarkeit herzustellen.[11]
Methoden
[Bearbeiten | Quelltext bearbeiten]Man unterscheidet zwischen einer einfachen Entfernung der Gebärmutter und erweiterten Operationen wie der schon erwähnten Hysterektomie mit Adnexektomie, der Hysterektomie mit (Beckenboden)-Plastiken und radikalen Operationen bei Krebserkrankungen. Die Wahl der Operationsmethode ist dabei von der Indikation zur Gebärmutterentfernung, nötigen Zusatzeingriffen, der Größe, Form und Beweglichkeit der Gebärmutter, der apparativen Ausstattung der Einrichtung und der Erfahrung des Operateurs abhängig.[7] Die Verwendung von Operationsrobotern hat bei der Hysterektomie bei einer Erhöhung der Kosten keine besseren Operationsergebnisse gebracht.[12]
Der Begriff der Totaloperation zur Abgrenzung der vollständigen Entfernung der Gebärmutter (totale Uterusexstirpation) von der subtotalen oder auch suprazervikalen Uterusexstirpation, bei welcher der Gebärmutterhals erhalten bleibt, sollte aufgrund der damit implizierten unterschiedlichen Vorstellungen vom Ausmaß der Operation vermieden werden, da er keine klare Bedeutung hat und von Ärzten und Laien teilweise unterschiedlich, oft missverständlich gebraucht wird.[2][3]
Hysterektomie bei gutartigen Erkrankungen
[Bearbeiten | Quelltext bearbeiten]Es stehen heute verschiedene Operationstechniken zur vollständigen oder teilweisen Entfernung einer Gebärmutter zur Verfügung:
- Exstirpation durch die Scheide (vaginale Hysterektomie)
- laparoskopische Hysterektomie (TLH – totale laparoskopische Hysterektomie)[13]
- kombiniert laparoskopisch und durch die Scheide (LAVH – laparoskopisch assistierte vaginale Hysterektomie, vaginal assistierte laparoskopische Hysterektomie)[13][14]
- laparoskopische Entfernung des Gebärmutterkörpers (LASH – laparoskopische suprazervikale Hysterektomie)[13][15][16][17]
- mittels Bauchschnitt (Laparotomie) mit Erhalt des Gebärmutterhalses (subtotale – auch suprazervikale – abdominale Hysterektomie)
- mittels Bauchschnitt ohne Erhalt des Gebärmutterhalses (totale abdominale Hysterektomie)
Bei einer vaginalen Entfernung wird der Gebärmutterhals mit entfernt. Bei laparoskopischen und abdominalen Methoden kann dieser erhalten bleiben. Die gleichzeitige Mitentfernung der Eierstöcke und Eileiter (Adnexe) ist bei laparoskopischem und abdominalem Zugang immer möglich, sollte jedoch nur bei entsprechender Indikation erfolgen. Bei der rein vaginalen Hysterektomie ist eine Entfernung der Adnexe prinzipiell ebenfalls möglich, jedoch zuweilen schwieriger bzw. in Einzelfällen auch nicht durchführbar. Ist die Entfernung notwendig, wird daher meist ein anderer Zugangsweg gewählt. Zur Behandlung einer Senkung der Gebärmutter wird, je nach Ursache, entweder der Weg durch die Scheide oder durch den Bauch gewählt, weil die zusätzlich notwendigen Eingriffe entweder ebenfalls durch die Scheide oder durch den Bauch erfolgen müssen.
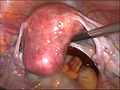
-
Gebärmutter vor der Entfernung per Bauchspiegelung
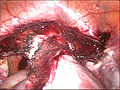
-
Bis zum Gebärmutterhals von den Adnexen, dem runden Mutterband und dem Ligamentum latum uteri abgetrennte Gebärmutter
-
Herausziehen (Extraktion) der Gebärmutter über die Scheide bei der totalen laparoskopischen Hysterektomie (TLH)
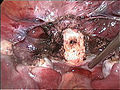
-
Zervixstumpf (weiß) nach Entfernung des Gebärmutterkörpers bei der laparoskopischen suprazervikalen Hysterektomie (LASH)
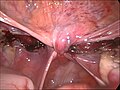
-
Über dem Scheidenende verschlossenes Bauchfell am Ende der Operation
Die Zahl der Hysterektomien in Deutschland ist seit vielen Jahren in etwa konstant. 2006 wurden 149.456 Hysterektomien vorgenommen. Davon betrafen 126.743 (84,8 Prozent) gutartige Veränderungen. Vor allem Frauen zwischen dem 40. und dem 49. Lebensjahr waren mit rund 50 Prozent aller Hysterektomien betroffen, Frauen zwischen 50 und 59 machten rund 20 Prozent aus. Damit entfielen fast 70 Prozent auf Frauen in oder um die Wechseljahre.[18] 2007 sank die Zahl der Hysterektomien auf 138.164.[19] In Deutschland treten, neben der vaginalen, abdominalen und der suprazervikalen Hysterektomie, immer mehr laparoskopische bzw. laparoskopisch assistierte Vorgehensweisen in den Vordergrund.[13][20][21]
In skandinavischen Ländern werden zwischen 21 und 36 Prozent der abdominalen Hysterektomien als suprazervikale Hysterektomien durchgeführt. In Dänemark wurde der Anteil an abdominalen totalen Hysterektomien innerhalb von zehn Jahren um 38 Prozent gesenkt. Waren es 1988 noch 173 solcher Eingriffe, wurden 1998 nur noch 107 pro 100.000 Frauen im Jahr gezählt. Der Anteil der abdominalen suprazervikalen Hysterektomien wuchs jedoch im gleichen Zeitraum von 7,5 auf 41 pro 100.000 Frauen im Jahr an. Insgesamt unterzogen sich in diesen zehn Jahren 67.096 Frauen in Dänemark einer Hysterektomie.[22] Die theoretischen Vorteile des Erhalts des Gebärmutterhalses, wie ein selteneres Auftreten von Senkungen, Harnentleerungsstörungen und Problemen im Bereich der Sexualität, lassen sich bislang in Studien nicht beweisen. Es bestehen jedoch Vorteile hinsichtlich der Operationszeit, des Blutverlustes und der Komplikationsraten gegenüber der kompletten Hysterektomie. Das Risiko für eine Gebärmutterhalskrebserkrankung am verbliebenen Zervixstumpf ist niedrig und entspricht mit 0,1 und 0,2 Prozent dem Risiko von 0,17 Prozent, ein Karzinom des Scheidenstumpfes nach vollständiger Hysterektomie zu bekommen. Für Länder, in denen keine Früherkennungsprogramme, wie Pap-Test und Kolposkopie, existieren und somit Screeninguntersuchungen vor und nach einer subtotalen Gebärmutterentfernung nicht gewährleistet sind, ist die suprazervikale Hysterektomie trotzdem nicht als Standardoperation oder als breit anzuwendende Alternative zur totalen Hysterektomie zu empfehlen.[15] Hinsichtlich der Patientenzufriedenheit, der Veränderung der Sexualität und des Selbstverständnisses, sich als Frau zu fühlen, lassen sich keine Unterschiede zwischen den Operationsmethoden nachweisen.[19]
In den USA werden jährlich etwa 600.000 Hysterektomien durchgeführt, dabei die meisten per Bauchschnitt (66 Prozent), 22 Prozent vaginal und nur 12 Prozent laparoskopisch. Der American Congress of Obstetricians and Gynecologists (ACOG), die größte Gynäkologengesellschaft in den USA, hält dabei den Anteil der abdominalen Eingriffe für deutlich zu hoch und empfiehlt, häufiger den vaginalen Zugang zu wählen.[23] Auch die American Academy of Gynecologic Laparoscopists (AAGL) empfiehlt minimal-invasive Verfahren, wie die vaginale oder laparoskopische Hysterektomie, für gutartige Erkrankungen der Gebärmutter.[24]
Die Cochrane Collaboration empfiehlt ebenfalls, im Vergleich aller Hysterektomiemethoden, dem vaginalen Zugang den Vorrang zu geben. Ist dies nicht möglich, stehen die laparoskopischen Varianten im Vordergrund. Nur wenn auch hier Gründe entgegenstehen, sollte die abdominale Hysterektomie erwogen werden.[25][26][27]
| Hysterektomieverfahren | Vorteile | Nachteile |
|---|---|---|
| abdominale Hysterektomie |
|
|
| vaginale Hysterektomie |
|
|
| laparoskopische suprazervikale Hysterektomie |
|
|
| laparoskopisch-assistierte vaginale Hysterektomie |
|
|
| totale laparoskopische Hysterektomie |
|
|
Hysterektomie bei bösartigen Erkrankungen
[Bearbeiten | Quelltext bearbeiten]Die sogenannte radikale Hysterektomie nach Wertheim-Meigs (totale Entfernung des Uterus unter Mitnahme des Halteapparates, des oberen Drittels der Vagina und der Beckenlymphknoten) ist die Standardtherapie bei einigen Stadien des Gebärmutterhalskrebs. Alternativ stehen heute die totale mesometriale Resektion (TMMR),[28] laparoskopisch assistierte vaginale radikale Hysterektomie (LAVRH), sowie die laparoskopische radikale Hysterektomie (LRH) zur Verfügung. Die alleinige radikale vaginale Totalexstirpation (oder vaginale Radikaloperation, wie sie 1908 durch Friedrich Schauta beim Collumkarzinom durchgeführt wurde[29]) der Gebärmutter (Schauta-Stoeckel-Operation) ohne Entfernung der Beckenlymphknoten ist heute nicht mehr angezeigt.
Bei noch bestehendem Kinderwunsch kann in frühen Stadien des Gebärmutterhalskrebses in manchen Fällen auf eine radikale Hysterektomie verzichtet und an eine radikale Trachelektomie gedacht werden. Dabei werden dann alleinig große Teile des Gebärmutterhalses entfernt, Gebärmutterhals und Gebärmutterkörper als solche bleiben jedoch erhalten. Eine ergänzend notwendige Lymphknotenentfernung kann dabei über eine Bauchspiegelung erfolgen. In diesem Fall bleibt die Fruchtbarkeit grundsätzlich erhalten.[30]
Während man bei Plattenepithelkarzinomen des Gebärmutterhalses junger Frauen auf die Entfernung der Adnexe verzichten kann, müssen diese beim Gebärmutterschleimhautkrebs (Endometriumkarzinom) des Gebärmutterkörpers in jedem Fall mit entfernt werden. Bei einem Ovarialkarzinom ist die Hysterektomie mit beiden Adnexen ebenfalls Bestandteil der Behandlung.[31][32][33]
Die Klassifikation nach Piver oder auch Rutledge-Piver, benannt nach den amerikanischen Gynäkologen M. Steven Piver und Felix Rutledge, unterscheidet fünf Grade der Radikalität einer Hysterektomie beim Gebärmutterhalskrebs:[34]
| Piver-Stadium | Bezeichnung | Ausdehnung des Eingriffs |
|---|---|---|
| I | extrafasziale Hysterektomie |
|
| II | modifiziertradikale Hysterektomie |
Letztlich handelt es sich um eine extrafasziale Hysterektomie mit Resektion der Parametrien medial der Ureteren. |
| III | „klassische“ radikale Hysterektomie |
|
| IV | erweiterte radikale Hysterektomie | wie Piver III, jedoch mit
|
| V | – | wie Piver IV, jedoch zusätzlich
|
Mitentfernung von Eileitern und Eierstöcken
[Bearbeiten | Quelltext bearbeiten]In der Veterinärmedizin sind reine Hysterektomien unüblich, da sie zu schweren Komplikationen führen können.
Lange Zeit wurde auch Frauen angeraten, bei einer Hysterektomie wegen gutartiger Erkrankungen gleichzeitig die Eierstöcke mit zu entfernen, um Eierstock- und Brustkrebs vorzubeugen. Frauen mit entfernten Eierstöcken erkranken zu einem Viertel seltener an Brustkrebs und haben ein um 96 Prozent niedrigeres Risiko für Eierstockkrebs. Allerdings treten nach Entfernung beider Eierstöcke mehr Lungenkrebs und koronare Herzerkrankungen auf, als wenn diese erhalten werden.[35] Vermehrte Schenkelhalsfrakturen, Fälle von Parkinson-Krankheit und Demenz sind ebenfalls bekannt und werden auf die verringerte Estrogenproduktion zurückgeführt.[36] Daher sollte bei Frauen unter 65 Jahren und ohne familiäres Risiko für Eierstock- oder Brustkrebs ein Erhalt der Eierstöcke im Zusammenhang mit einer Gebärmutterentfernung in Erwägung gezogen werden,[37][38] solange nicht der Nutzen dieses zusätzlichen Eingriffs belegt werden kann.[39]
Die Entfernung der Eileiter im Rahmen einer Hysterektomie senkt das Risiko für einen neuen Eingriff aufgrund von Komplikationen im Bereich der Eileiter, insbesondere von Infektionen. Deren Häufigkeit wird mit bis zu 35 % angegeben.[40][41] Zudem bedeutet die Mitentfernung der Eileiter eine Verringerung des Risikos bösartiger Tumoren an Eileitern, Eierstöcken und Peritoneum, da die Eileiter als Ausgangspunkt einiger dieser Erkrankungen gelten. Allerdings ist die Risikoreduktion nur gering und der Eingriff unter Umständen mit einer Verschlechterung der Eierstockdurchblutung und damit einer etwas früheren Menopause verbunden, so dass die Maßnahme kontrovers diskutiert wird.[42]
Bei bösartigen Erkrankungen kann man bei Plattenepithelkarzinomen des Gebärmutterhalses junger Frauen auf die Entfernung der Adnexe verzichten. Beim Gebärmutterschleimhautkrebs (Endometriumkarzinom) des Gebärmutterkörpers, Adenokarzinomen der Zervix und Eierstockkrebs müssen Eierstöcke und Eileiter jedoch in jedem Fall entfernt werden.[31][32][33]
Anästhesiologische Aspekte
[Bearbeiten | Quelltext bearbeiten]Während bei der vaginalen Hysterektomie auch regionale Anästhesieverfahren wie die Spinalanästhesie genutzt werden können, wird bei den Verfahren mit abdominellem Zugang in der Regel eine Allgemeinanästhesie (Narkose) eingesetzt. Diese wird als Intubationsnarkose durchgeführt, da insbesondere bei laparoskopischen Eingriffen eine Larynxmaske keinen ausreichenden Schutz vor der Aspiration von Magensaft gewährleistet. Ausgeprägte kardiovaskuläre Vorerkrankungen können die Durchführbarkeit einer Laparoskopie aufgrund der Nebenwirkungen auf Herz-Kreislauf- und Lungenfunktion einschränken, so dass alternativ ein offener Zugang gewählt werden muss. Frauen sind allerdings im höheren Lebensalter weniger von solchen Erkrankungen betroffen als Männer. Bei Patientinnen mit ausgeprägter vorhergehender vaginaler Blutung kann eine akute Anämie mit niedrigem Hämoglobin-Wert vorliegen, die gegebenenfalls die Therapie mit Blutprodukten erforderlich macht.[43]
Gynäkologische Operationen, speziell die Hysterektomie, werden mit im Vergleich zu anderen Eingriffen deutlich erhöhten Raten an postoperativer Übelkeit und Erbrechen (PONV, bei bis zu 80 % der Patientinnen) in Verbindung gebracht. Ob der Eingriff dafür eine spezifische Ursache ist, wird kontrovers diskutiert, nach aktueller Datenlage aber eher abgelehnt. Wahrscheinlich ist die hohe Inzidenz hauptsächlich durch das Risikoprofil der Patientinnen bedingt, da der Faktor weibliches Geschlecht per se mit einer zwei- bis dreifachen statistischen Rate an PONV einhergeht. Zur Prophylaxe und Behandlung der postoperativen Übelkeit existieren eine Vielzahl von Therapiemöglichkeiten, etwa die Durchführung einer total intravenösen Anästhesie sowie die Verabreichung verschiedener Antiemetika (Dexamethason, Setrone u. a.).[44]
Die Wertheim-Meigs-Operation ist ein großer Eingriff des Abdomens, der oft in Kombinationsanästhesie (Allgemeinanästhesie in Kombination mit einer thorakalen Periduralanästhesie) durchgeführt wird. Die potenziell großen Flüssigkeitsverschiebungen und -verluste sowie eine oft vorbestehende Anämie machen eine differenzierte Überwachung (ggf. invasive Blutdruckmessung, zentralvenöse Katheterisierung) und Volumentherapie sowie gegebenenfalls Transfusion von Blutkonserven notwendig. Bei Patientinnen ohne kardiale Vorerkrankungen kann durch eine kontrollierte Hypotension der Blutverlust verringert werden. Postoperativ ist oft die Betreuung auf einer Wach- oder Intensivstation notwendig. Den Patientinnen kann eine (peridurale oder intravenöse) patientenkontrollierte Schmerztherapie angeboten werden.[43]
Rehabilitation
[Bearbeiten | Quelltext bearbeiten]Nach einer Hysterektomie bei gutartigen Erkrankungen sind meist keine expliziten Rehabilitationsmaßnahmen notwendig. Innerhalb von ca. 3 Wochen nach der Operation erfolgt die Wundheilung und Regeneration, welche durch eine Physiotherapie unterstützt werden kann. In dieser Zeit sollen sich die Patientinnen ausruhen und schonen. Eine volle Belastbarkeit des Körpers ist durchschnittlich nach 4 Wochen wiederhergestellt. Im Anschluss einer Gebärmutterentfernung bei bösartigen Erkrankungen sowie weiteren onkologischen Therapiemaßnahmen ist oft ein Aufenthalt in einer Rehaklinik sinnvoll. Dort werden körperliche Nachwirkungen der Erkrankung behandelt sowie die Patientinnen durch eine psychologische Betreuung unterstützt.
Folgen
[Bearbeiten | Quelltext bearbeiten]Eine Hysterektomie beendet die Gebärfähigkeit einer Frau unwiderruflich. Die Menstruationsblutung kann bei der vollständigen Entfernung der Gebärmutter nicht mehr auftreten, da das Zielorgan, die Gebärmutterschleimhaut, für die zyklischen, hormonell bedingten Veränderungen nicht mehr besteht. Bei der subtotalen Operation unter Belassen des Gebärmutterhalses sind dagegen leichte zyklische Blutungen nicht selten.[15]
Nach einer Hysterektomie ohne Adnexe ist mit einem etwas früheren Eintritt in die Wechseljahre zu rechnen, was durch verschlechterte Blutversorgung der Eierstöcke bedingt zu sein scheint.[45][46]
Aktuelle Studien konnten jedoch zeigen, dass die Patientenzufriedenheit nach Hysterektomie sehr hoch ist.[19][47] Der Wegfall der Menstruationsblutung und die Unnötigkeit einer Empfängnisverhütung wird von vielen Frauen als Verbesserung des Lebens empfunden. Es gibt bisher keine überzeugenden Hinweise auf nennenswerte Störungen des psychischen Wohlbefindens oder des Sexualempfindens.[48][49] Individuell wurde über verschieden ausgeprägte sexuelle Veränderungen, wie Verlust des uterinen Orgasmusempfindens, teilweise spürbare Verkürzung und Trockenheit der Scheide sowie Libidoverlust berichtet.[50] Ebenso leiden manche Frauen erheblich unter dem Verlust der Gebärmutter. Ein zentraler Aspekt ist hierbei das Gefühl, keine „komplette“ Frau mehr zu sein.[2]
Insgesamt gibt es jedoch nur wenige Hinweise auf eine Verschlechterung, sondern zahlreiche Berichte über eine Verbesserung der Sexualfunktion durch eine Hysterektomie.[49][51][52][53][54] 85 Prozent der Patientinnen aus der Maryland Women’s Health Study berichteten 6, 12, 18 und 24 Monate nach Hysterektomie über eine gestiegene Geschlechtsverkehrsfrequenz, weniger Beschwerden beim Verkehr (Dyspareunie), einen häufigeren Orgasmus, eine gesteigerte Libido und weniger vaginale Trockenheit.[55]
Komplikationen
[Bearbeiten | Quelltext bearbeiten]Typische seltene Komplikationen und damit Risiken der Hysterektomie sind Wundheilungsstörungen, Verletzung von Darm, Harnleiter[56] oder der Harnblase, sowie (Nach-)Blutungen. Die deutsche Bundesgeschäftsstelle Qualitätssicherung fand 2008 von 77.549 Patientinnen (ohne Karzinom, ohne Endometriose und ohne Voroperation im gleichen Operationsgebiet) eine Organverletzung bei 724 Patientinnen (0,9 Prozent).[57] Harnwegsinfekte sind relativ häufig zu beobachten. Mittelfristig können Frauen nach einer Hysterektomie über Wochen und Monate unter Schmerzen, Schwäche, Müdigkeit und Abgeschlagenheit leiden.[58]
Narbenbrüche, Verwachsungen, Senkungserscheinungen des Vaginalstumpfes und Schmerzen beim Geschlechtsverkehr (Dyspareunie) kommen vor.[19] Wissenschaftler des Karolinska-Instituts in Schweden haben in einer Studie mit über 165.000 Frauen mit und 480.000 Frauen ohne Hysterektomie herausgefunden, dass die Entfernung der Gebärmutter das Risiko für eine Harninkontinenz (Blasenschwäche) erhöht. So mussten doppelt so viele Frauen nach einer Hysterektomie wegen einer Harninkontinenz behandelt werden wie Frauen mit Gebärmutter. Besonders gefährdet sind Frauen, deren Gebärmutter noch vor der Menopause („Letzte regelrechte Regelblutung“) entfernt wurde, oder die mehrere Kinder zur Welt gebracht haben.[59] Dabei war die vaginale Hysterektomie mit der höchsten Rate an nachfolgenden Senkungsoperationen assoziiert.[19][59] Die Ursachen dafür sind jedoch unklar.[19] Der Erhalt des Gebärmutterhalses bietet gegenüber der vollständigen Gebärmutterentfernung keinen Schutz vor einer später entstehenden Harninkontinenz,[60] deren Zusammenhang mit der Hysterektomie in einigen Untersuchungen sogar grundsätzlich angezweifelt wird.[61][62]
Das Zerkleinern (Morcellement) von Myomen und Uteri kann in sehr seltenen Fällen unabhängig vom Operationsweg (Bauchschnitt, Operation über die Scheide oder per Bauchspiegelung) auch zur Streuung von gutartigen, jedoch auch von zunächst nicht bekanntem bösartigen Gewebe im Bauchraum führen.[63][64][65]
Alternativen
[Bearbeiten | Quelltext bearbeiten]Gutartige Erkrankungen
[Bearbeiten | Quelltext bearbeiten]Immer wieder wurde kritisiert, dass zu viele Hysterektomien durchgeführt werden, zumal die Hysterektomie mit Risiken verbunden ist und gerade für viele gutartige Veränderungen alternative Behandlungsmethoden existieren.[66][67]
Menstruationsstörungen können hormonell behandelt werden. Außerdem besteht in vielen Fällen die Möglichkeit einer Endometriumablation, also einer isolierten thermischen oder hysteroskopischen Zerstörung der Gebärmutterschleimhaut.[68]
Eine Endometriose kann, mit Ausnahme der Adenomyosis, bei der die Endometrioseherde in der Gebärmuttermuskulatur liegen, separat operiert werden. Auch eine hormonelle Behandlung ist erfolgversprechend.
Myome in der Gebärmutterhöhle, sogenannte submuköse Myome, können oftmals hysteroskopisch entfernt werden.[69] Myome in der Muskulatur (intramurale Myome) oder an der Außenseite der Gebärmutter (subseröse Myome) können laparoskopisch oder mit Bauchschnitt unter Erhalt der Gebärmutter operiert werden. Außerdem besteht die Möglichkeit der Uterusmyomembolisation[70] und die gezielte Ultraschallerwärmung der Myome. Allerdings ist bei beiden Varianten keine histologische Untersuchung möglich.[71][72][73][74]
Die Bundesgeschäftsstelle für Qualitätssicherung (BQS) empfiehlt – vor allem bei jüngeren Frauen – zunächst alle konservativen Behandlungsmöglichkeiten auszuschöpfen, bevor eine Hysterektomie vorgenommen wird.[66]
-
Entfernung eines einzelnen Myoms per Bauchspiegelung als Alternative zur Hysterektomie
-
Naht nach Entfernung eines Myoms per Bauchspiegelung
-
Hysteroskopische Sicht auf ein submuköses Myom der Gebärmutterhinterwand
-
Endometriose auf dem Bauchfell zwischen Blase und Gebärmutter (Entfernung unter Erhalt der Gebärmutter möglich)
-
Adenomyosis uteri (Endometriose der Gebärmutterwand – gebärmuttererhaltende Operation meist nicht möglich)
Bösartige Erkrankungen
[Bearbeiten | Quelltext bearbeiten]Beim Zervixkarzinom ist in den Stadien III und IV bzw. bei nicht operablen Patientinnen eine primäre kombinierte Strahlentherapie oder eine simultane Radiochemotherapie möglich. Auch ein Endometriumkarzinom kann bei hohem Operationsrisiko durch Nebenerkrankungen oder schwierige Operationsbedingungen, wie bei hochgradiger Adipositas, durch eine kombinierte Strahlentherapie behandelt werden. Beim Ovarialkarzinom ist eine Heilung durch eine alleinige Chemotherapie nicht möglich, kann jedoch das Fortschreiten der Erkrankung hemmen bzw. Folgeerscheinungen, wie Aszites, vermindern. Eine Strahlentherapie ist bei Ovarialkarzinom nicht angezeigt.[31][32][33]
Statistiken, regionale Unterschiede
[Bearbeiten | Quelltext bearbeiten]Die teilweise oder vollständige operative Entfernung der Gebärmutter ist einer der häufigsten chirurgischen Eingriffe der Frauenheilkunde und Geburtshilfe, welche zu einem vergleichsweise hohen und regional unterschiedlichen Anteil auch von Belegabteilungen erbracht wird.[75] Während bei den Hysterektomien (OPS-Code 5-683) zwischen 2007 und 2009 in Deutschland eine deutliche Reduzierung von ca. 138.000 auf ca. 125.000 erfolgte, erhöhte sich die Anzahl der subtotalen Uterusextirpationen (OPS-Code 5-682) im selben Zeitraum von ca. 9.000 auf ca. 14.000 deutlich.
Es zeigen sich deutschlandweit deutliche Unterschiede in der OP-Häufigkeit in den einzelnen Kreisen. Im Kreis mit dem höchsten OP-Index (Ist-OP-Anzahl/erwartete OP-Anzahl) von 1,7 liegt dieser mehr als drei Mal höher als im Kreis mit dem niedrigsten Index (0,5). Werden die 20 Kreise mit dem höchsten und die 20 Kreise mit dem niedrigsten OP-Index nicht in die Betrachtung einbezogen, so erhält man nur noch eine Spannbreite des OP-Index für die übrigen Kreise von ca. dem Zweifachen (0,8 bis 1,4). Die OP-Häufigkeit bei den Frauen, die in den (größeren) Städten leben, fällt eher durchschnittlich oder unterdurchschnittlich aus.[76]
In verschiedenen Ländern werden die regionalen Unterschiede in der Häufigkeit der Durchführung von Hysterektomien und die Indikationsstellung zur Hysterektomie bereits seit vielen Jahrzehnten diskutiert, weil in Untersuchungen gezeigt wurde, dass ein erheblicher Teil der Hysterektomien ohne ausreichende Indikationsstellung erfolgt.[77] Die aktuell noch bestehenden Variationen deuten darauf hin, dass die Indikationsstellung zur Hysterektomie offenbar nach wie vor in manchen Regionen großzügiger erfolgt als in anderen. So wird auf fachlicher Ebene verstärkt diskutiert, welche Indikationen zur Hysterektomie unstrittig sind und bei welchen Indikationen Entscheidungsspielräume bei Patientinnen und/oder Ärzten vorhanden sind, die eine Vermeidung der Hysterektomie möglich machen.[5]
Die abnehmende Gesamtzahl der Hysterektomien könnte ein Hinweis darauf sein, dass die Indikationsstellung bereits in den letzten Jahren zunehmend kritischer erfolgt. Allerdings werden bspw. bei der Behandlung des Uterus myomatosus neue und vor allem konservative Verfahren nicht in ausreichendem Umfang angewendet.[5] Daher kann von Bedeutung sein, in welchem Maße den einzelnen behandelnden Krankenhäusern und Ärzten alle für die Entscheidung relevanten diagnostischen Möglichkeiten zur Verfügung stehen und in welcher Geschwindigkeit Erkenntnisse über neue Behandlungsverfahren allgemeine Verbreitung und Anwendung finden. Davon betroffen sind auch die behandelnden niedergelassenen Frauenärzte, die die Entscheidung an welches Krankenhaus sich die Patientinnen zur weiteren Versorgung wenden, mit beeinflussen. Solche Unterschiede können die regionalen Variationen in der Hysterektomiehäufigkeit mit begründen.[78]
Im Jahr 2013 zeigte sich in einer Studie des Robert Koch-Instituts, die Teil des Gesundheitsmonitorings ist, dass es einen sehr deutlichen Zusammenhang zwischen dem sozialen Status der Patientinnen und einer Gebärmutterentfernung gibt. Bei den 8.152 Frauen, die an der Studie teilnahmen, wurde bei Frauen mit niedrigem Sozialstatus doppelt so häufig eine Hysterektomie durchgeführt wie bei Patientinnen mit einem höheren Bildungsgrad. Dies wird zum einen darauf zurückgeführt, dass besser gebildete Menschen generell im Durchschnitt über eine bessere Gesundheit verfügen; sie sind weniger Stress ausgesetzt, sie betreiben eine bessere Gesundheitsvorsorge und nehmen eher Maßnahmen zur Früherkennung von Krankheiten in Anspruch. Andererseits seien die Ärzte eher bereit, diesen Patientinnen Behandlungsmethoden anzubieten und zu erklären, mit denen sich die Entfernung der Gebärmutter vermeiden lasse.[6][79]
Rechtliches
[Bearbeiten | Quelltext bearbeiten]Auch für die Entfernung der Gebärmutter bedarf es, ebenso wie für alle anderen Operationen, neben einer medizinischen Indikation selbstverständlich des Einverständnisses der Patientin. Im Rahmen der ärztlichen Aufklärung sollten der Patientin mögliche Alternativen sowie Vor- und Nachteile der Operationsmethoden dargelegt werden.[80]
Prinzipiell ist es möglich, einer Patientin mit Kinderwunsch im Rahmen einer Hysterektomie Eizellen zu entnehmen und diese für eine spätere Befruchtung einzufrieren oder nach einer Gebärmutterentfernung für eine In-vitro-Fertilisation zu gewinnen.[81][82][83] Die hieraus entstandenen Embryonen können aber nur von einer Leihmutter ausgetragen werden. Dies ist jedoch in vielen Ländern nicht erlaubt. In Deutschland etwa verbietet das Embryonenschutzgesetz eine Leihmutterschaft.[84][85]
Geschichte
[Bearbeiten | Quelltext bearbeiten]Erste Versuche, eine Gebärmutterentfernung durchzuführen, ließen sich bis ins 1. Jahrhundert zu Zeiten des Soranos von Ephesos zurückverfolgen, damals zur Behandlung einer infizierten Gebärmutter bei einer Senkung. Bis ins 18. Jahrhundert war eine Hysterektomie meist nicht zu überleben. Anfang des 19. Jahrhunderts gab es wieder nachgewiesene Versuche, Gebärmutterentfernungen durchzuführen. Eine der ersten Hysterektomien geschah 1812, als Giovanni Battista Palletta in Mailand einen Gebärmutterhals wegen eines Zervixkarzinoms entfernen wollte und dabei eine totale Hysterektomie durchführte, welche die Patientin jedoch nur zwei Tage überlebte.[86]
Erste vollständige Hysterektomien bei Krebserkrankungen der Gebärmutter auf vaginalem Weg gelangen 1801 Friedrich Benjamin Osiander, 1813 Konrad Johann Martin Langenbeck und 1822 Johann Nepomuk Sauter.[87][88][89] Im November 1843 nahm Charles Clay in Manchester eine suprazervikale Hysterektomie vor. Jedoch erst nachdem James Young Simpson 1847 Chloroform zur Narkose eingeführt hatte, waren in der Chirurgie und damit auch in der Chirurgischen Frauenheilkunde größere Fortschritte möglich.[90] Im Jahr 1876 publizierte der Mailänder Arzt Edoardo Pòrro (1842–1902) eine supravaginale Amputation des frisch-puerperalen Corpus uteri nach Entwicklung des Kindes.[91]
Walter Burnham (Lowell, Massachusetts) entfernte im Juni 1853 ungeplant eine Gebärmutter über einen Bauchschnitt. Die erste erfolgreiche vollständige abdominale Hysterektomie im Jahr 1853 ist mit dem Namen Gilman Kimball (1804–1892, ebenfalls Lowell, Massachusetts) verbunden. Am 2. Januar 1861 wurde eine erste vaginale Gebärmutterentfernung ohne Verletzung von Blase und Enddarm von S. Choppin in New Orleans durchgeführt, die erst 1876 von A. Petterson in Glasgow wiederholt wurde.[86][92]
Die erste erfolgreiche Entfernung von Gebärmutter und Eierstöcken gelang 1863[93] dem Anatomen und Gynäkologen Eugène Koeberlé (1828–1915), der bis 1880 an der Clinique de la Toussaint in Straßburg tätig war.[94]
In der zweiten Hälfte des 19. Jahrhunderts wurde die Hysterektomie zuweilen auch zur Therapie der Hysterie angewandt. Man nahm an, die Hysterie sei eine typisch weibliche Eigenschaft und hänge mit der Gebärmutter zusammen, eine Vorstellung, die sich bis in die Antike zurückverfolgen lässt (siehe auch Geschichte der Frauenleiden).
Im Jahr 1878 führte Wilhelm Alexander Freund in Breslau bei einer Patientin mit Gebärmutterhalskrebs die erste wiederholbare vollständige Gebärmutterentfernung (als abdominelle Totalexstirpation) über einen Bauchschnitt aus,[95][96] weitere Ärzte verfeinerten die Methoden und entwickelten sie weiter.
Am 12. August 1879 führte der Chirurg Vincenz Czerny in Heidelberg eine Hysterektomie über die Scheide durch, welche erstmals systematisch von ihm beschrieben werden konnte.[86][97] Da die Ergebnisse (allerdings mit einer Rezidivrate von über 90 %)[98] besser waren als bei der Freundschen Operation, wurde in der Folgezeit die vaginale Operation bevorzugt.[99][100] (So etwa ab 1884 durch O. Thelen am St. Josephs-Hospital in Elberfeld[101]). Eine erweiterte vaginale Totalexstirpation der Gebärmutter hatte 1894 Alwin Mackenrodt (1859–1925) durchgeführt, eine erweiterte abdominale Totalexstirpation Ernst Wertheim 1897.[102]
Bis ungefähr 1950 wurde daher bei gutartigen Erkrankungen der subtotalen Entfernung oder der vaginalen Entfernung der Vorzug gegeben. Seit der Einführung antimikrobieller Substanzen setzte sich die vollständige abdominale Entfernung, neben der auf vaginalem Weg, durch, weil die Gefahr eines Gebärmutterhalskrebses an der sonst verbliebenen Zervix (Gebärmutterhals) durch Krebsfrüherkennung reduziert werden konnte.[86]
Karl August Schuchardt gelang 1893 in Stettin die erste erweiterte vaginale Gebärmutterentfernung bei Gebärmutterhalskrebs, die 1901 von dem Wiener Gynäkologen Friedrich Schauta, später von Walter Stoeckel an der Charité in Berlin und Isidor Alfred Amreich in Wien weiterentwickelt wurde.[103] Vom österreichischen Gynäkologen Ernst Wertheim wurde bis 1898 eine radikale Operationsmethode über einen Bauchschnitt entwickelt, die später der Amerikaner Joe Vincent Meigs weiterentwickelte.[104] Im Jahr 1901 beschrieb Albert Döderlein die mediane Spaltung als neue Methode der vaginalen Uterusexstirpation.[105]
Nach Vorarbeiten von Kurt Semm führte Harry Reich 1988 in Pennsylvania die erste laparoskopische Hysterektomie durch.[106] In den 1980er Jahren wurden mehrere Varianten einer teilweisen Gebärmutterentfernung entwickelt. Semm beschrieb 1991 eine laparoskopische subtotale Hysterektomie. Er nannte seine Version CISH (Classic Intrafascial Semm Hysterectomy) und kombinierte das Zerkleinern (Morcellement) des Uterus mit einer Ausschälung der Zervix.[107] Die Methode erhielt jedoch nie eine weitergehende Anerkennung.[108] Jacques Donnez (Belgien) publizierte 1993 die laparoskopische suprazervikale Hysterektomie, welche in dieser Form heute weit verbreitet ist.[109][110]
Seit den 1990er Jahren kam es durch die Einführung neuer Operationstechniken, wie der laparoskopischen Wertheim-Operation,[111] der Trachelektomie[30][112][113] oder der Totalen mesometrialen Resektion des Uterus[28] und der Möglichkeit der Lymphknotenentfernung mittels einer Laparoskopie, zu einer beginnenden Individualisierung der operativen Therapie bei bösartigen Erkrankungen mit teilweise bewusst reduzierter, teilweise verbesserter Vollständigkeit (Radikalität) der chirurgischen Karzinomentfernung.[114][115]
Literatur
[Bearbeiten | Quelltext bearbeiten]- S3-Leitlinie Hysterektomie, Indikation und Methodik der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG). In: AWMF online (Stand 2014)
- Franziska Prütz, Elena von der Lippe: Hysterektomie. In: GBE kompakt. 5(1), 2014. rki.de (PDF; 395 kB).
- Faktencheck Gesundheit. Regionale Unterschiede in der Gesundheitsversorgung. Bertelsmann Stiftung, 2011, S. 36 f., OCLC 801768058.
- Hans A. Hirsch, Otto Käser, Franz Anton Iklé: Atlas of gynecologic surgery: including breast surgery and related urologic and intestinal surgical operations. Georg Thieme, 1997, ISBN 0-86577-595-8 (eingeschränkte Vorschau in der Google-Buchsuche).
- Diethelm Wallwiener, Walter Jonat, Rolf Kreienberg, Klaus Friese, Klaus Diedrich, Matthias W. Beckmann (Hrsg.): Atlas der gynäkologischen Operationen. Georg Thieme, 2008, ISBN 978-3-13-357007-7.
- Bernhardt Uhl: OP-manual Gynäkologie und Geburtshilfe: Alles für den OP und die Station. Georg Thieme, 2004, ISBN 3-13-130831-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Jürgen Durst: Bauchchirurgie: Operationslehre mit topographischer Anatomie: Standards der Viszeralchirurgie. Schattauer, 1998, ISBN 3-7945-1590-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- Bernhard Schüssler, H. Peter Scheidel, Michael K. Hohl: Hysterektomie Update. In: Frauenheilkunde aktuell. 3, 2008. (frauenheilkunde-aktuell.ch (PDF); PDF; 810 kB)
- Hellmuth Pickel, O. Reich, R. Winter: Hysterektomie von der Antike bis heute. In: Frauenarzt. 51, 2010, S. 879–882. (frauenarzt.de (PDF); PDF; 219 kB)
- Liselotte Mettler, Wael Sammur, Thoralf Schollmeyer: Sun beams on hysterectomies. In: Gynecol Surg. 8, 2011, S. 255–267. doi:10.1007/s10397-011-0657-9
- Friedhelm Köhler: Die langfristige Bewältigung einer Gebärmutteroperation. In: Praxis der Psychotherapie und Psychosomatik. 32, 1987, S. 266ff.
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Regionale Unterschiede der Häufigkeit einer Gebärmutterentfernung ( vom 12. November 2013 im Internet Archive) auf Faktencheck-Gesundheit.de
- A. Wattiez, V. Thoma, J. Nassif: Laparoscopic total hysterectomy for benign conditions: standard technique. Epublication: WeBSurg.com, 2008
- T. Falcone: Laparoscopically assisted vaginal hysterectomy. Epublication: WeBSurg.com, 2002
- A. Wattiez, E. Kovoor, J. Nassif, I. Miranda-Mendoza: Laparoscopic hysterectomy with adnexectomy. Epublication: WeBSurg.com, 2009
- A. Wattiez: Laparoscopic hysterectomy with pelvic lymphadenectomy for cervical cancer. Epublication: WeBSurg.com, 2007
- Gebärmutterentfernung. ( vom 10. Februar 2013 im Webarchiv archive.today) Informationen der Arbeitsgemeinschaft Gynäkologische Endoskopie (AGE) der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe
- Laparoskopische suprazervikale Hysterektomie ( vom 6. November 2010 im Internet Archive) Informationen der Arbeitsgemeinschaft Gynäkologische Endoskopie (AGE) der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. G. Freytag Verlag / Hölder-Pichler-Tempsky, München/Wien 1965.
- ↑ a b c Gunhild Buse: Als hätte ich ein Schatzkästlein verloren. Hysterektomie aus der Perspektive einer feministisch-theologischen Medizinethik. LIT Verlag, Berlin / Hamburg / Münster 2003, ISBN 3-8258-6037-X (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Gisela Lösche: Die Sinnhaftigkeit des Begriffes „Totaloperation“. (1984) In: Paul R. Franke, Matthias David (Hrsg.): Der andere Weg zum gleichen Ziel – Psychosomatische Frauenheilkunde. Ausgewählte Beiträge der Symposien der Ostdeutschen Gesellschaft für Psychosomatische Gynäkologie und Geburtshilfe 1984–1994. akademos Wissenschaftsverlag, Hamburg/Berlin 2002, ISBN 3-934410-34-0.
- ↑ D. T. Rein, T. Schmidt, M. Fleisch, R. Wagner, W. Janni: Multimodale Behandlung des Uterus myomatosus. In: Frauenarzt. 50, 2009, S. 752–758. frauenarzt.de ( vom 31. März 2010 im Internet Archive) (PDF; 520 kB)
- ↑ a b c A. Taran, G. Gaffke, M. Rüsch, H. Heuer, B. Hosang, J. Ricke, S.-D. Costa: Die moderne multimodale Therapie des Uterus myomatosus: Wann ist eine Hysterektomie indiziert? In: Ärzteblatt Sachsen-Anhalt. 19, 2008, S. 38–45. aerzteblatt-sachsen-anhalt.de ( vom 26. Januar 2009 im Internet Archive; PDF; 375 kB)
- ↑ a b F. Prütz, H. Knopf, E. von der Lippe, C. Scheidt-Nave, A. Starker, J. Fuchs: Prävalenz von Hysterektomien bei Frauen im Alter von 18 bis 79 Jahren. In: Bundesgesundheitsblatt. 2013, Nr. 5–6, S. 716–722. doi:10.1007/s00103-012-1660-7. Abgerufen am 2. Oktober 2013.
- ↑ a b M. Thill, A. Hornemann, D. Fischer, K. Diedrich, C. Altgassen: Vaginale und abdominale Hysterektomie. In: Gynäkologe. 41, 2008, S. 328–336. doi:10.1007/s00129-008-2130-z
- ↑ C. Yaman, J. Reist, F. Wutzlhofer, G. Tews: Gasbrand im Wochenbett. In: Geburtsh Frauenheilk. 60, 2000, S. 169–171. doi:10.1055/s-2000-5916
- ↑ P. Husslein: Postpartale Blutungen. In: Gynäkologe. 30, 1997, S. 769–774. doi:10.1007/s001290050181
- ↑ Christina A. Rossi, Richard H. Lee, Ramen H. Chmait: Emergency Postpartum Hysterectomy for Uncontrolled Postpartum Bleeding: A Systematic Review. In: Obstet Gynecol. 115, 2010, S. 637–644. PMID 20177297. doi:10.1097/AOG.0b013e3181cfc007
- ↑ Beschluss - 1 BvR 3295/07 - des BVerfG vom 11. Januar 2011
- ↑ J. D. Wright, C. V. Ananth, S. N. Lewin u. a.: Robotically Assisted vs Laparoscopic Hysterectomy Among Women With Benign Gynecologic Disease. In: JAMA. 309(7), 2013, S. 689–698. doi:10.1001/jama.2013.186
- ↑ a b c d D. Dian, B. Rack, C. Schindlbeck, W. Janni, K. Friese: Endoskopische Hysterektomie. LAVH, LASH, TLH und NOTE-AVH. In: Gynäkologe. 41, 2008, S. 343–348. doi:10.1007/s00129-008-2134-8
- ↑ B. Uhl, D. Thiemann-Janßen: Minimal-invasive Operationsmethode bei extrem großen Uteri: vaginal-assistierte laparoskopische Hysterektomie. In: Gyn. 13, 2008, S. 154–156.
- ↑ a b c Leitlinie Die laparoskopische suprazervikale Hysterektomie (LASH) der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe, Arbeitsgemeinschaft Gynäkologische Endoskopie (AGE). In: AWMF online (Stand 11/2009)
- ↑ D. Rein, T. Schmidt: Laparoskopische suprazervikale Hysterektomie (LASH). In: Gynäkologe, 38, 2005, S. 959–967. doi:10.1007/s00129-005-1763-4
- ↑ A. Salfelder, R. P. Lueken, C. Bormann, A. Gallinat, C. P. Moeller, D. Busche, W. Nugent, E. Krueger, A. Nugent, V. Scotland: Die suprazervikale Hysterektomie in neuem Licht. Wiederentdeckung als minimalinvasive Methode. In: Frauenarzt, 44, 2003, S. 1071–1975. frauenarzt.de ( vom 4. März 2016 im Internet Archive; PDF; 118 kB)
- ↑ Christine Wolfrum: Vorschnelle Schnitte. In: Apotheken Umschau. 1. Juni 2008.
- ↑ a b c d e f g Andreas Müller, Falk C. Thiel, Stefan P. Renner, Mathias Winkler, Lothar Häberle, Matthias W. Beckmann: Hysterektomie – ein Vergleich verschiedener Operationsverfahren. In: Dtsch Arztebl., 107, 2010, S. 353–359. doi:10.3238/arztebl.2010.0353. deutsche Version
- ↑ L. Mettler, N. Ahmed-Ebbiary, T. Schollmeyer: Laparoscopic hysterectomy: challenges and limitations. In: Minim Invasive Ther Allied Technol., 14, 2005, S. 145–159.
- ↑ C. Jäger, G. Sauer, R. Kreienberg: Die laparoskopisch assistierte vaginale Hysterektomie – Sinn oder Unsinn. In: Geburtsh Frauenheilk. 67, 2007, S. 628–632. doi:10.1055/s-2007-965243
- ↑ H. Gimbel, A. Settnes, A. Tabor: Hysterectomy on benign indication in Denmark 1988–1998. A register based trend analysis. In: Acta obstetricia et gynecologica Scandinavica. Band 80, Nummer 3, März 2001, S. 267–272. PMID 11207494. doi:10.1034/j.1600-0412.2001.080003267.x
- ↑ ACOG: ACOG Recommends Vaginal Hysterectomy as Approach of Choice. In: Obstet Gynecol. 114, 2009, S. 1156–1158. doi:10.1097/AOG.0b013e3181c33c72
- ↑ Laurie Barclay: AAGL Recommends Vaginal or Laparoscopic Approach for Hysterectomies. In: MedscapeCME Clinical Briefs. 16. November 2010.
- ↑ Neil Johnson, David Barlow, Anne Lethaby, Emma Tavender, Liz Curr, Ray Garry: Methods of hysterectomy: systematic review and meta-analysis of randomised controlled trials. In: BMJ. 330, 2005, S. 1478. doi:10.1136/bmj.330.7506.1478
- ↑ T. E. Nieboer, N. Johnson, A. Lethaby, E. Tavender, E. Curr, R. Garry, S. van Voorst, B. W. Mol, K. B. Kluivers: Surgical approach to hysterectomy for benign gynaecological disease. In: Cochrane Database Syst Rev. 2009, S. CD003677. PMID 19588344
- ↑ A. Hornemann, M. Thill, M. K. Bohlmann, D. Fischer, K. Diedrich, C. Altgassen: Hysterektomie – vaginal, abdominal oder laparoskopisch assistiert? In: Gynäkologe. 41, 2008, S. 337–342. doi:10.1007/s00129-008-2129-5
- ↑ a b M. Höckel: Totale mesometriale Resektion: Ein neues Radikalitätsprinzip in der operativen Therapie des Zervixkarzinoms. In: Onkologe. 12, 2006, S. 901–907. doi:10.1007/s00761-006-1110-y
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 60.
- ↑ a b C. Altgassen: Trachelektomie. In: Gynäkologe. Band 42, 2009, S. 925–931. doi:10.1007/s00129-009-2406-y
- ↑ a b c 2k-Leitlinie Diagnostik und Therapie des Zervixkarzinoms der Deutschen Krebsgesellschaft e. V. und der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe. In: AWMF online (Stand 11/2009)
- ↑ a b c 2k-Leitlinie Diagnostik und Therapie des Endometriumkarzinoms der Deutschen Krebsgesellschaft e. V. und der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe. In: AWMF online (Stand 11/2009)
- ↑ a b c 2k-Leitlinie Diagnostik und Therapie maligner Ovarialtumoren der Deutschen Krebsgesellschaft e. V. und der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe. In: AWMF online (Stand 11/2009)
- ↑ M Steven Piver, Felix Rutledge, Julian P. Smith: Five classes of extended hysterectomy for women with cervical cancer. In: Obstet Gynecol. 44, 1974, S. 265–272. (Vorschau)
- ↑ W. H. Parker, M. S. Broder, Z. Liu, D. Shoupe, C. Farquhar, J. S. Berek: Ovarian conservation at the time of hysterectomy for benign disease. In: Clin Obstet Gynecol. 50, 2007, S. 354–361. PMID 17513923
- ↑ W. H. Parker, V. Jacoby, D. Shoupe, W. Rocca: Effect of bilateral oophorectomy on women’s long-term health. In: Womens Health. (Lond Engl) 5 (2009), S. 565–576. PMID 19702455
- ↑ D. Shoupe, W. H. Parker, M. S. Broder, Z. Liu, C. Farquhar, J. S. Berek: Elective oophorectomy for benign gynecological disorders. In: Menopause. 14, 2007, S. 580–585. PMID 17476148
- ↑ L. T. Shuster, B. S. Gostout, B. R. Grossardt, W. A. Rocca: Prophylactic oophorectomy in premenopausal women and long-term health. In: Menopause Int. 14, 2008, S. 111–116. PMID 18714076
- ↑ L. J. Orozco, A. Salazar, J. Clarke, M. Tristan: Hysterectomy versus hysterectomy plus oophorectomy for premenopausal women. In: Cochrane Database Syst Rev. 2008, S. CD005638. PMID 18646133
- ↑ A. N. Morse, C. B. Schroeder u. a.: The risk of hydrosalpinx formation and adnexectomy following tubal ligation and subsequent hysterectomy: A historical cohort study. In: Am. J. Obstet. Gynecol. 194, 2006, S. 1273–1276.
- ↑ F. Ghezzi, A. Cromi, G. Siesto, V. Bergamini, F. Zefiro, P. Bolis: Infectious morbidity after total laparoscopic hysterectomy: does concomitant salpingectomy make a difference? In: BJOG – An International Journal of Obstetrics and Gynaecology. 116, 2009, S. 589–593. doi:10.1111/j.1471-0528.2008.02085.x. PMID 19250369
- ↑ Ingo B. Runnebaum, Marc P. Radosa, Michel Mueller: Elektive Salpingektomie bei der Hysterektomie: Ja oder Nein? In: Frauenheilkunde aktuell. 1/2012, S. 39–43. frauenheilkunde-aktuell.ch ( des vom 2. November 2013 im Internet Archive; PDF; 855 kB) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ a b R. Rossaint, C. Werner, D. Zwissler (Hrsg.): Die Anästhesiologie. Allgemeine und spezielle Anästhesiologie, Schmerztherapie und Intensivmedizin. 2. Auflage. Springer, Berlin 2008, ISBN 978-3-540-76301-7.
- ↑ C. C. Apfel, N. Roewer: Postoperative Übelkeit und Erbrechen. In: Anaesthesist. 53(4), Apr 2004, S. 377–389 Review. PMID 15190867
- ↑ W. Braendle: Zusammenhang von Hysterektomie und Menopause. In: Gynäkologe. 38, 2005, S. 936–938. doi:10.1007/s00129-005-1762-5
- ↑ Cynthia M. Farquhar, Lynn Sadler, Sally A. Harvey, Alistair W. Stewart: The association of hysterectomy and menopause: a prospective cohort study. In: BJOG. 112, 2005, S. 956–962. doi:10.1111/j.1471-0528.2005.00696.x
- ↑ Frauengesundheitsbericht Bremen 2001 (PDF; 1,3 MB)
- ↑ K. J. Carlson, B. A. Miller, F. J. Fowler Jr: The Maine Women’s Health Study: I. Outcomes of hysterectomy. In: Obstet Gynecol. 83, 1994, S. 556–565. PMID 8134066
- ↑ a b S. A. Farrell, K. Kieser: Sexuality after hysterectomy. In: Obstet Gynecol. 95, 2000, S. 1045–1051. PMID 10808032
- ↑ A. Graziottin u. a.: The Prevalence of Hypoactive Sexual Desire Disorder in Surgically Menopausal Women: An Epidemiological Study of Women in Four European Countries. In: J Sex Med. 6, 2009, S. 2143–2153. PMID 19453880 (alessandragraziottin.it [PDF; 212 kB])
- ↑ T. Rannestad, O. J. Eikeland, H. Helland, U. Qvarnstrom: The quality of life in women suffering from gynecological disorders is improved by means of hysterectomy. Absolute and relative differences between pre- and postoperative measures. In: Acta Obstet Gynecol Scand. 80, 2001, S. 46–51. PMID 11167188
- ↑ C. Yazbeck: Sexual function following hysterectomy. In: Gynecol Obstet Fertil. 32, 2004, S. 49–54. PMID 14736601
- ↑ G. Khastgir, J. W. Studd, J. Catalan: The psychological outcome of hysterectomy. In: Gynecol Endocrinol. 14, 2000, S. 132–141. PMID 10836201
- ↑ Jan-Paul W R Roovers, Johanna G van der Bom, C Huub van der Vaart, A Peter M Heintz: Hysterectomy and sexual wellbeing: prospective observational study of vaginal hysterectomy, subtotal abdominal hysterectomy, and total abdominal hysterectomy. In: BMJ. 327, 2003, S. 774–778. doi:10.1136/bmj.327.7418.774
- ↑ J. C. Rhodes, K. H. Kjerulff, P. W. Langenberg, G. M. Guzinski: Hysterectomy and sexual functioning. In: JAMA. 282, 1999, S. 1934–1941. PMID 10580459. (online)
- ↑ Leitlinie Operationsbedingte Verletzungen des Ureters in der Gynäkologie und Geburtshilfe der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe, Arbeitsgemeinschaft Medizinrecht (AG MedR). In: AWMF online (Stand 11/2009)
- ↑ Qualitätsbericht Organverletzungen bei Hysterektomie ( des vom 24. Mai 2012 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. der deutschen Bundesgeschäftsstelle Qualitätssicherung
- ↑ A. H. DeCherney, G. Bachmann, K. Isaacson, S. Gall: Postoperative fatigue negatively impacts the daily lives of patients recovering from hysterectomy. In: Obstet Gynecol. 99, 2002, S. 51–57. PMID 11777510
- ↑ a b D. Altman, F. Granath, S. Cnattingius, C. Falconer: Hysterectomy and risk of stress-urinary-incontinence surgery: nationwide cohort study. In: The Lancet. 370, 2007, S. 1494–1499. doi:10.1016/S0140-6736(07)61635-3
- ↑ M. Robert, A. Soraisham, R. Sauve: Postoperative urinary incontinence after total abdominal hysterectomy or supracervical hysterectomy: a metaanalysis. In: Am J Obstet Gynecol. 198, 2008, S. 264 e1-5. PMID 18199420
- ↑ M. E. Vierhout: The end to the myth that hysterectomy has negative effects on the function of pelvic organs. In: Ned Tijdschr Geneeskd. 151, 2007, S. 1214–1216. PMID 17583086
- ↑ M. Abdel-Fattah, J. Barrington, M. Yousef, A. Mostafa: Effect of total abdominal hysterectomy on pelvic floor function. In: Obstet Gynecol Surv. 59, 2004, S. 299–304. PMID 15024230
- ↑ Michael A. Seidman, Titilope Oduyebo, Michael G. Muto, Christopher P. Crum, Marisa R. Nucci, Bradley J. Quade: Peritoneal Dissemination Complicating Morcellation of Uterine Mesenchymal Neoplasms. In: PLoS ONE. 7, 2012, S. e50058. PMID 23189178. doi:10.1371/journal.pone.0050058
- ↑ M. W. Beckmann, I. Juhasz-Böss, D. Denschlag, P. Gaß, T. Dimpfl, P. Harter, P. Mallmann, S. P. Renner, S. Rimbach, I. Runnebaum, M. Untch, S. Y. Brucker, D. Wallwiener: Surgical Methods for the Treatment of Uterine Fibroids – Risk of Uterine Sarcoma and Problems of Morcellation: Position Paper of the DGGG. In: Geburtshilfe Frauenheilkd., 75, 2015, S. 148–164. doi:10.1055/s-0035-1545684; thieme-connect.de (PDF; 234 kB; deutsch).
- ↑ G. Cucinella, R. Granese, G. Calagna, E. Somigliana, A. Perino: Parasitic myomas after laparoscopic surgery: An emerging complication in the use of morcellator? Description of four cases. In: Fertility and Sterility. Band 96, Nr. 2, 2011, S. e90–e96, doi:10.1016/j.fertnstert.2011.05.095, PMID 21719004.
- ↑ a b Qualitätsindikator: Indikationsstellung zur Hysterektomie. ( des vom 18. Juni 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. Bundesgeschäftsstelle für Qualitätssicherung (BQS)
- ↑ Coco Masters: Are Hysterectomies Too Common? Time, 17. Juli 2007, zuletzt abgerufen am 23. November 2009.
- ↑ J. Hucke, U. Füllers, M. Hesseling: Endouterine Eingriffe – Abrasio, Hysteroskopie und Endometriumablation. In: Gynäkologe. 33, 2000, S. 665–671. doi:10.1007/s001290050619
- ↑ Percy Brandner, Klaus J. Neis: Die hysteroskopische Resektion submuköser Myome. In: Frauenarzt. 44, 2003, S. 1063–1069. frauenarzt.de ( vom 2. Oktober 2015 im Internet Archive; PDF; 128 kB)
- ↑ T. J. Kröncke, M. David: Ergebnisse des 2. Radiologisch-gynäkologischen Expertentreffens – Uterusarterienembolisation (UAE) zur Myombehandlung. (Konsensuspapier), In: Fortschr Röntgenstr. 179, 2007, S. 325–326. doi:10.1055/s-2007-972191
- ↑ Myome zerstören mit fokussiertem Ultraschall unter Kernspin-Kontrolle
- ↑ Magnetresonanzgeführte (MR) Therapie von Uterusmyomen mit fokussiertem Ultraschall – eine nichtinvasive Behandlung zur Verbesserung der Lebensqualität. ( vom 6. September 2009 im Internet Archive)
- ↑ B. Aydeniz, S. Duda, R. Kurek, C. Gall, C. Claussen, K. J. Neis, D. Wallwiener, B. Schauf: Myomembolisation oder laparoskopische Gefäßligatur? Gedanken zur Entscheidungsfindung. In: Frauenarzt. 44, 2003, S. 1274–1280. frauenarzt.de ( vom 2. Oktober 2015 im Internet Archive; PDF; 280 kB)
- ↑ M. David, G. Warschewske, S. Hengst, T. Ehrenstein: Die uteruserhaltende Myombehandlung. In: Frauenarzt. 44, 2003, S. 1164–1176. frauenarzt.de ( vom 15. November 2012 im Internet Archive; PDF; 173 kB)
- ↑ Statistisches Bundesamt: Gesundheit. Grunddaten der Krankenhäuser. Fachserie 12, Reihe 6.1.1. Statistisches Bundesamt, Wiesbaden 2011.
- ↑ Faktencheck Gesundheit. Regionale Unterschiede in der Gesundheitsversorgung. Bertelsmann Stiftung, 2011, S. 36 f.
- ↑ D. Klemperer: Der Einfluß nicht-medizinischer Faktoren auf die Frequenz von Operationen und Untersuchungen. 1990.
- ↑ Faktencheck Gesundheit. Regionale Unterschiede in der Gesundheitsversorgung. Bertelsmann Stiftung, 2011, S. 36 f.
- ↑ Gebärmutterentfernungen bei Frauen mit niedrigem Sozialstatus doppelt so häufig. ( des vom 4. Oktober 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Deutsche Hebammenzeitung. Nr. 9/2013. Abgerufen am 2. Oktober 2013.
- ↑ Markus Parzeller, Maren Wenk, Barbara Zedler, Markus Rothschild: Aufklärung und Einwilligung bei ärztlichen Eingriffen. In: Dtsch Arztebl. 104, 2007, S. A-576. (online)
- ↑ A. Raziel, M. Schachter, D. Strassburger, D. Komarovsky, R. Ron-El, S. Friedler: Eight years’ experience with an IVF surrogate gestational pregnancy programme. In: Reprod Biomed Online. 11, 2005, S. 254–258. PMID 16168227
- ↑ J. M. Goldfarb, C. Austin, B. Peskin, H. Lisbona, N. Desai, J. R. de Mola: Fifteen years experience with an in-vitro fertilization surrogate gestational pregnancy programme. In: Hum Reprod., 15, 2000, S. 1075–1078. PMID 10783355, humrep.oxfordjournals.org
- ↑ G. I. Meniru, I. L. Craft: Experience with gestational surrogacy as a treatment for sterility resulting from hysterectomy. In: Hum Reprod. 12, 1997, S. 51–54. PMID 9043901; humrep.oxfordjournals.org (PDF; 61 kB)
- ↑ Embryonenschutzgesetz
- ↑ Datenbank zu den rechtlichen Regelungen der Fortpflanzungsmedizin in europäischen Ländern. ( vom 10. Oktober 2010 im Internet Archive) Max-Planck Institut für ausländisches und internationales Strafrecht
- ↑ a b c d Geschichte der Hysterektomie. (PDF; 563 kB). In: Michaela Otto: Subtotale versus totale Hysterektomie: Klinische Parameter, subjektive Patienteneinschätzungen und Kosten. Dissertation. Universität Ulm, 2006, S. 2–4.
- ↑ Heilung des Mutterkrebses und krankhafter Auswüchse aus der Gebärmutter durch den Schnitt. In: Hufelands Journal, Band 16, 1803, St. 3, S. 133–135; Textarchiv – Internet Archive.
- ↑ Beschreibung zweier, vom Herausgeber verrichteten, Extirpationen krebshafter, nicht vorgefallener Gebärmütter. In: C. J. Langenbeck (Herausgeber). Bibliothek für die Chirurgie. Deuerlich, Göttingen 1813, S. 698–728 (Digitalisat)
- ↑ Die gänzliche Exstirpation der carcinomatösen Gebärmutter: ohne selbst entstandenen oder künstlich bewirkten Vorfall vorgenommen und glücklich vollführt, mit näherer Anleitung, wie diese Operation gemacht werden kann. W. Wallis, Konstanz 1822; archive.org.
- ↑ Chris Sutton: Hysterectomy: a historical perspective. In: Baillière’s Clinical Obstetrics and Gynaecology, 11, 1997, S. 1–22. doi:10.1016/S0950-3552(97)80047-8
- ↑ Gustav Döderlein: Der heutige Stand der abdominalen Schnittentbindung. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. 56–61, hier: S. 56.
- ↑ Michael J. O’Dowd,Elliot Elias Philipp: The history of obstetrics and gynaecology. Informa Health Care, 2000, ISBN 1-85070-040-0 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eugène Koeberlé: Exstirpation de l’uterus et des ovaires. In: Gaz. méd. Strasbourg. Band 23, 1863, S. 101.
- ↑ Barbara I. Tshisuaka: Koeberlé, Eugène. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. de Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 770.
- ↑ Wilhelm A. Freund: Eine neue Methode der Exstirpation des ganzen Uterus. In: Berliner Klin Wochenschrift. 1878, S. 417–418.
- ↑ W. A. Freund: Eine neue Methode der Exstirpation des ganzen Uterus. Sammlung klinischer Vorträge. In: R. Volkmann (Hrsg.): Verbindung mit deutschen Klinikern. 41 (1878), Verlag Breitkopf und Härtel, Leipzig, S. 911–924.
- ↑ J. Zander: Milestones in Gynecology and Obstetrics. In: H. Ludwig, K. Thomsen (Hrsg.): Proceedings of the XIth World Congress of Gynecology and Obstetrics, Berlin, 1985. Springer Verlag, Heidelberg 1986, ISBN 3-540-15559-7, S. 3–24.
- ↑ Hanna K. Probst, Axel W. Bauer: Wegbereiterin und Wegbegleiterin neuer chirurgischer Therapiekonzepte. Die Tumorpathologie in der Frauenheilkunde während der zweiten Hälfte des 19. Jahrhunderts. In: Fachprosaforschung – Grenzüberschreitungen. Band 10, 2014, S. 89–110, hier: S. 94.
- ↑ H. Dietel: 75 Jahre Nordwestdeutsche Gesellschaft für Gynäkologie und Geburtshilfe 1909 bis 1984. (PDF; 494 kB)
- ↑ H. Ludwig: Die Gründung der Deutschen Gesellschaft für Gynäkologie (1885). ( vom 16. Oktober 2014 im Internet Archive; PDF; 749 kB) In: Frauenarzt. 46, 2005, S. 928–932.
- ↑ O. Thelen: Bericht über sechs Uterusexstirpationen. In: Centralblatt für Gynäkologie, Band 10, Nr. 36, 4. September 1886, S. 585–588.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 52.
- ↑ M. Possover, S. Kamprath, A. Schneider: The historical development of radical vaginal operation of cervix carcinoma. In: Zentralbl Gynakol. Band 119, 1997, S. 353–358. PMID 9340975
- ↑ O. Käser, F. A. Iklè: Atlas der gynäkologischen Operationen. Georg Thieme Verlag, Stuttgart 1965, S. 263–307.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 60.
- ↑ H. Reich, J. De Caprio, F. McGlynn: Laparoscopic Hysterectomy. In: J Gynecol Surg. 5, 1989, S. 213–216. doi:10.1089/gyn.1989.5.213
- ↑ Kurt Semm: Hysterektomie per laparotomiam oder per pelviscopiam. In: Geburtsh Frauenheilk. 51, 1991, S. 996–1003. PMID 1838998
- ↑ Bernhard Schüssler, H. Peter Scheidel, Michael K. Hohl: Hysterektomie Update. In: Frauenheilkunde aktuell. 3, 2008. frauenheilkunde-aktuell.ch (PDF; 810 kB)
- ↑ J. Donnez, M. Smets, R. Polet, S. Bassil, M. Nisolle: LASH: laparoscopic supracervical (subtotal) hysterectomy. In: Zentralbl Gynäkol. 117, 1995, S. 629–632. PMID 8585357
- ↑ J. Donnez, M. Nisolle: Laparoscopic supracervical (subtotal) hysterectomy (LASH). In: J Gynecol Surg. 9, 1993, S. 91–94. PMID 10171972.
- ↑ M. Canis, G. Mage, J. L. Pouly, C. Pomel, A. Wattiez, E. Glowaczover, M. A. Bruhat: Laparoscopic radical hysterectomy for cervical cancer. In: Baillieres Clin Obstet Gynaecol. 9, 1995, S. 675–689. PMID 8821247
- ↑ D. Dargent, J. Brun, M. Roy u. a.: La trachélectomie élargie (TE), une alternative á l’hysterectomie radicale dans le traitement des cancers infiltrants développés sur la face externe du col utérin. In: JOBGYN. 2, 1994, S. 285–292.
- ↑ D. Dargent, X. Martin, A. Sacchetoni, P. Mathevet: Laparoscopic vaginal radical trachelectomy: a treatment to preserve the fertility of cervical carcinoma patients. In: Cancer. 88, 2000, S. 1877–1882. PMID 10760765
- ↑ B. Bojahr, W. Straube, G. Köhler, R. Lober, G. Schwesinger: Initial experiences and outcome of gasless laparoscopic pelvic lymph node excision combined with Schauta vaginal radical hysterectomy in stage IB cervix carcinoma. In: Zentralbl Gynakol. 119, 1997, S. 492–499. PMID 9432827
- ↑ M. Possover, N. Krause, K. Plaul, R. Kühne-Heid, A. Schneider: Laparoscopic para-aortic and pelvic lymphadenectomy: experience with 150 patients and review of the literature. In: Gynecol Oncol. 71, 1998, S. 19–28. PMID 9784314