Endometriose
| Klassifikation nach ICD-10 | |
|---|---|
| N80 | Endometriose |
| N80.0 | Endometriose des Uterus (Adenomyosis uteri) |
| N80.1 | Endometriose des Ovars |
| N80.2 | Endometriose der Tuba uterina |
| N80.3 | Endometriose des Beckenperitoneums |
| N80.4 | Endometriose des Septum rectovaginale und der Vagina |
| N80.5 | Endometriose des Darmes |
| N80.6 | Endometriose in Hautnarbe |
| ICD-10 online (WHO-Version 2019) | |
Endometriose (von „Endometrium“, ‚Gebärmutterschleimhaut‘, mit dem Suffix altgriechisch ωσις = „-osis“ für Erkrankungen, ersteres von altgriechisch ἔνδον = endon, „innen“ und μήτρα mētra = „Gebärmutter“) ist eine häufige, gutartige, oft schmerzhafte chronische Erkrankung von Frauen, bei der Gewebe, das der Gebärmutterschleimhaut (dem Endometrium) ähnlich ist, außerhalb der Gebärmutterhöhle (ektop) vorkommt.
Wie die normale Gebärmutterschleimhaut verändert sich auch das Endometriosegewebe während des Menstruationszyklus und kann Gewebeblutungen, Narbenbildung und Schmerzen bewirken. Die Endometriose tritt meist im unteren Bauch- bzw. Beckenraum auf, zum Beispiel auf der Gebärmutter oder den Eileitern. Häufig sind dabei die Eierstöcke betroffen. Ein Befall der Gebärmuttermuskulatur heißt Adenomyose oder Adenomyosis uteri. Eine Ausbreitung auf die Scheidenwand und den Darm (Dickdarm) ist möglich. Eine Endometriose kann auch in der Lunge oder in anderen inneren Organen wie im Gehirn vorkommen, auch wenn dies selten der Fall ist (extragenitale Endometriose). Eine Endometriose kann eine Ursache von Unfruchtbarkeit bei Frauen sein. Die Ursache für die Entstehung einer Endometriose ist bisher medizinisch noch nicht bekannt. Zudem besteht keine Möglichkeit einer Prophylaxe. Primär erfolgt die Behandlung einer Endometriose operativ durch Entfernung oder Zerstörung der betroffenen Herde. Sekundär kann eine hormonelle Hemmung des Zyklus erfolgen, um die Wahrscheinlichkeit des Wiederauftretens der Endometriose zu verringern. Bei einer weit verteilten, diffusen Endometriose in der Gebärmutterwand (Adenomyose) ist sogar eine Gebärmutterentfernung indiziert, da es keine andere Therapie gibt.
Epidemiologie
Häufigkeit
Die Endometriose ist nach Myomen die zweithäufigste gynäkologische Erkrankung.[1] Etwa 4 bis 12 Prozent aller Frauen erkranken zwischen der Pubertät und den Wechseljahren daran, in Deutschland jedes Jahr etwa 40.000. Genaue Angaben zur Häufigkeit (Prävalenz und Inzidenz) existieren nicht. Die Prävalenz unterscheidet sich nach der klinischen Situation. So liegt sie bei Frauen mit Regelschmerzen bei 40 bis 60 Prozent, bei Frauen mit chronischen Unterleibsschmerzen bei über 30 Prozent und bei Frauen mit unerfülltem Kinderwunsch bei etwa 20 bis 30 Prozent.[2] Bei Verwandten ersten Grades (Mütter, Schwestern) von Endometriosepatientinnen fand sich die Erkrankung mit einer Prävalenz von 6,9 Prozent ebenfalls, dagegen nur in 1 Prozent der Mütter und Schwestern der Ehemänner.[3] Bei gynäkologischen Operationen über einen Bauchschnitt findet sich in 1 bis 15 Prozent, bei allen gynäkologischen Bauchspiegelungen (Laparoskopien) in 5 bis 53 Prozent und bei Laparoskopien von Kinderwunschpatientinnen in 30 bis 50 Prozent eine Endometriose. Dabei weisen die betroffenen Frauen nur zur Hälfte Symptome auf.[1]
Diagnosestellung
Die Endometriose ist eine hormonabhängige Erkrankung, die extrem selten bei präpubertären Mädchen und selten bei postmenopausalen Frauen vorkommt. Sie wird am häufigsten bei Frauen zwischen dem 25. und 35. Lebensjahr diagnostiziert.[4] Die Patientinnen sind bei Diagnosestellung im Mittel 28 Jahre alt.[5] Die Diagnose kann jedoch manchmal bereits wenige Monate nach der ersten Regelblutung,[6] in Einzelfällen auch vor der ersten Regelblutung[7][8][9] gestellt werden.
| Dauer bis zur Diagnose | |
|---|---|
| Frauen ≤ 19 Jahre | 12,1 Jahre |
| Frauen ≥ 30 Jahre | 3,0 Jahre |
| Patientinnen mit Kinderwunsch | 4,0 Jahre |
| Patientinnen mit Unterbauchbeschwerden | 7,0 Jahre |
Die Endometriose wird häufig erst spät diagnostiziert.[11][12] Durchschnittlich vergehen 3 bis 11 Jahre zwischen ersten Symptomen und dem Stellen der Diagnose.[13][4][14][15][16] In diesem Zeitintervall haben etwa 50 Prozent der betreffenden Frauen fünf oder mehr Ärzte aufgesucht.[12] Je jünger die Patientinnen bei den ersten Anzeichen sind, desto mehr Zeit vergeht, bis die Endometriose diagnostiziert wird.[4][10]
Gründe für die verzögerte Diagnosestellung sind die unspezifischen Symptome,[17] die wie Menstruationsbeschwerden (Dysmenorrhoe) teilweise von Mädchen, Frauen und Ärzten als normal angesehen werden. Daher werden Beschwerden verzögert berichtet und von Ärzten teilweise falsch gedeutet, wobei eine Vielzahl von Differentialdiagnosen als mögliche Ursache von Beschwerden infrage kommt.
Unspezifische Behandlungen wie die Gabe hormoneller Verhütungsmittel können die Beschwerden lindern und damit die korrekte Diagnostik ebenfalls verzögern. Ultraschalluntersuchungen werden als alleinige Untersuchung bei Unterbauchbeschwerden eingesetzt, obwohl damit lediglich Endometriosezysten der Eierstöcke sicher zu entdecken sind.[18][19][20][21]
Lokalisation

Die Endometriose befindet sich meist am Bauchfell im unteren Bauchraum bzw. kleinen Becken. Häufig sind dabei der Douglas-Raum, die Bänder zwischen Gebärmutter und Kreuzbein und die Eierstöcke betroffen. Eine Ausbreitung auf die Scheidenwand und den Darm sowie das Bindegewebe zwischen Scheide und Darm sind nicht selten. Weiterhin findet sich die Erkrankung in der Gebärmuttermuskulatur, dem Wurmfortsatz sowie am Zwerchfell. Auch die Vulva, der Damm und der Bauchnabel können betroffen sein. Sehr selten befällt die Endometriose die Lunge,[8] Skelettmuskulatur[22] und das Gehirn.[1]
Im Bauchraum wird zwischen einer oberflächlichen peritonealen Endometriose, die nur das Bauchfell betrifft, und der sogenannten tiefen infiltrierenden Endometriose unterschieden, die in Strukturen wie Harnblasen- und Darmwand oder Harnleiter hineinwächst.[10]
Nach Operationen können sich Endometrioseherde auch in Narben finden, beispielsweise nach Kaiserschnitten.[23]
| befallene Struktur | Häufigkeit des Befalls in Prozent |
|---|---|
| Ligamentum sacrouterinum | 60 |
| Eierstöcke | 52 |
| Douglas-Raum | 28 |
| Harnblase | 15 |
| Ligamentum latum | 16 |
| Mastdarm | 12 |
| Mesosalpinx | 10 |
| Ligamentum rotundum | 5 |
| Eileiter | 2 bis 8 |
| Appendix vermiformis | 2 |
Entstehung

Ursachen
Die Ursachen für die Entstehung der Endometriose sind nicht vollständig geklärt. Es gibt zahlreiche Erklärungsmodelle, die jedoch bislang nicht zu beweisen sind. Die Transplantationstheorie nach Sampson geht davon aus, dass lose Gebärmutterschleimhautzellen bei der retrograden Menstruation durch die Eileiter, aber auch über das Blut und über die Lymphgefäße sowie bei Operationen verschleppt werden und sich an anderer Stelle ansiedeln. Bei der Metaplasietheorie nach Meyer entstehen Endometrioseherde an Ort und Stelle aus embryonalen Bauchhöhlenzellen, dem sogenannten Zölomepithel. Die Induktionstheorie stellt eine Kombination aus der Transplantations- und Metaplasietheorie dar. Genetische Faktoren scheinen ebenfalls eine Rolle bei der Erkrankung zu spielen.[24] Umweltgifte wie PCB, DDT oder Dioxine können unter anderem ähnlich wie Östrogene wirken und damit möglicherweise das endokrine System bereits während der vorgeburtlichen Phase stören. Immunologische Ursachen werden ebenfalls diskutiert.[25] Die Archimetratheorie von Leyendecker sieht die Endometriose als Folge einer Adenomyosis oder deren Frühmanifestationen und somit als eine Erkrankung der Archimetra an. Dieses Konzept stützt sich auf spezifische Veränderungen des normalen Endometriums bei Frauen mit Endometriose, auf archimetrale Funktionsstörungen wie Hyper- und Dysperistaltik sowie auf eine archimetrale Infiltration in die Gebärmuttermuskulatur (Myometrium).[26][27] Das Archimetrakonzept wurde von Leyendecker zur Tissue Injury And Repair-Theorie (TIAR) weiterentwickelt. Danach führt eine gesteigerte Peristaltik der Gebärmuttermuskulatur zu kleinsten Verletzungen in dieser (Autotraumatisierung). Im Reparationsmechanismus werden lokal Östrogene freigesetzt, welche wiederum die Peristaltik verstärken. Daraus könnte ein Teufelskreis entstehen.[28][29] Es gibt allerdings auch Hinweise, dass ein Zusammenhang mit erhöhten Östrogenen für die Adenomyosis besteht, nicht jedoch für andere Endometrioselokalisationen.[30] Eine Studie zeigte Zusammenhänge zwischen Fusobacterium-Infektionen und dem Auftreten von Endometriose[31].
Keine der vorliegenden Theorien kann jedoch bislang das komplexe Bild der Endometriose erklären. Vielmehr muss man ein multimodales Konzept aus den bisher bekannten Theorien annehmen, in dem eine Vielzahl von verschiedenen Faktoren zusammenwirkt.[5] So sah Weinschenk eine Störung des vegetativen Nervensystems als Auslöser der fehlerhaften Peristaltik.[32][33]
| Theorie/Ursache | Beschreibung | Belege |
|---|---|---|
| Transplantationstheorie |
|
|
| Metaplasietheorie |
|
|
| Induktionstheorie |
| |
| Genetik |
|
|
| Umweltgifte |
|
|
| Immunologische Ursachen |
|
|
| Tissue Injury And Repair-Theorie (TIAR) |
|
|
| Konzept der Fehlfunktion des vegetativen Nervensystems |
|
|
| Zell- und molekularbiologische Konzepte |
| |
| Aromatase-Konzept |
|
|
Risikofaktoren
Hauptrisikofaktor ist die Menstruation selbst. Frauen mit frühem Einsetzen der Menstruation und später Menopause haben ein erhöhtes Risiko. Frauen, welche ihre Regelblutung durch die ständige Einnahme von hormonellen Kontrazeptiva unterdrücken, haben ein geringeres Risiko, an Endometriose zu erkranken.[40] Bei Frauen mit einem kurzen Zyklus unter 28 Tagen und einer regelmäßigen Blutungsdauer über sieben Tagen fand sich ein erhöhtes Risiko. Auch Frauen, deren Familienmitglieder bereits erkrankt sind, zeigen ein höheres Auftreten der Erkrankung. Als weitere Risikofaktoren gelten späte erste Schwangerschaft,[5] Eingriffe an der Gebärmutter[41][42] und Übergewicht.[5][10] Allerdings wird auch ein Zusammenhang mit niedrigem Body-Mass-Index und der Körperfettverteilung diskutiert.[12][43][44][45][46]
Eine wachsende Anzahl von Studien hat eine Korrelation zwischen einem Ungleichgewicht im vaginalen Mikrobiom und dem Auftreten von Endometriose gezeigt.[47] Diese Korrelation wird durch eine Überlastung des Immunsystems im Kontext der retrograden Menstruation vermittelt, bei der es versagt, Zellen zu erkennen und zu eliminieren, die außerhalb des vaginalen Umfelds gelangen. Durch Stören der normalen Immunfunktion führe eine „Dysbiose“ zu erhöhten Mengen proinflammatorischer Zytokine, einem beeinträchtigten Immunüberwachungssystem und veränderten Immunzellprofilen. Tatsächlich führt die Aktivierung von Toll-like-Rezeptoren in Makrophagen zu einer verstärkten Aktivität dieses Immunzelltyps. Diese wiederum sezernieren Faktoren (wie das proinflammatorische Zytokin Interleukin 8), die dazu beitragen, ein entzündliches Umfeld zu schaffen, was die Proliferation und Adhäsion von endometrialen Zellen begünstigt.[48][47]
Symptome
Leitsymptome der Endometriose sind mit dem Menstruationszyklus verbundene krampfartige Schmerzen von steigender Intensität (Dysmenorrhoe), aber auch chronische Bauch- und Rückenschmerzen kommen vor. Von einigen Wissenschaftlern wird die Dysmenorrhoe dabei nicht als Folge, sondern als Frühsymptom der Endometriose angesehen.[32][33] Bei Befall des Douglas-Raums können auch Schmerzen beim Geschlechtsverkehr oder schmerzhafter oder erschwerter Stuhlgang (Dyschezie) auftreten.[5] Ebenso sind Schmerzen beim Harnlassen beschrieben.[40][49] Die Regelschmerzen korrelieren dabei weder mit der Größe der Endometrioseherde noch mit einer speziellen anatomischen Lage. Die Entstehung der Dauerschmerzen ist mit einer starken Ausdehnung der Herde vergesellschaftet. Man geht davon aus, dass tief eindringende Endometrioseinseln kleinste Nerven im Beckenraum entweder durch Kompression oder durch Infiltration reizen.[50] Die Regelblutung kann verstärkt und verlängert sein.[10] Eine Harnstauung kann auf eine tiefe infiltrierende Endometriose hindeuten.[51] Bei rund der Hälfte der Patientinnen verursacht die Krankheit jedoch keine oder nur geringe Symptome.[5]
| Symptome | Häufigkeit in Prozent |
|---|---|
| Dysmenorrhoe | ca. 95 |
| Unterbauchschmerzen | ca. 85 |
| Übelkeit | ca. 82 |
| Darmsymptome | ca. 78 |
| verlängerte und verstärkte Menstruation | ca. 65 |
| Beschwerden beim Geschlechtsverkehr (Dyspareunie) | ca. 60 |
| Kopfschmerz, Schwindel | n/a |
| Magenbeschwerden | n/a |
| unerwünschte Kinderlosigkeit | n/a |
| häufige Infekte | n/a |
| subfebrile Temperaturen | n/a |
Endometriosebedingte Sterilität
Die Fruchtbarkeit (Fekundabilität) gesunder Frauen liegt zwischen 0,15 und 0,20 erfolgreichen Schwangerschaften pro Monat und nimmt mit dem Alter ab. Bei unbehandelten Frauen mit Endometriose liegt die Fekundabilität zwischen 0,02 und 0,10 und damit unter der Gesunder. Es wird geschätzt, dass 30 bis 50 % der Frauen mit Endometriose unfruchtbar (infertil) sind.[53] Bisher ist jedoch kein ursächlicher Zusammenhang zwischen Endometriose und Sterilität identifiziert worden, wenn nicht organische Veränderungen im Bereich der Eileiter und Eierstöcke vorliegen. Die Endometriose ist jedoch häufig mit Sterilität verbunden.[54] Mechanische Faktoren durch Verwachsungen der Eileiter sind als Ursache akzeptiert.[55] Ein durch die gesteigerte Gebärmutterperistaltik zu schneller und zu unregelmäßiger Transport von Spermien und ein zu hoher intrauteriner Druck können die Befruchtung wie auch die Einnistung der Eizelle verhindern.[32] Weitere Faktoren können eine gestörte Eierstock- und Eileiterfunktion, ein gestörtes Follikelwachstum, eine vorzeitige Umwandlung nicht geplatzter Eibläschen in Gelbkörper (Luteinisierter Unrupturierter Follikel-, auch LUF-Syndrom), eine Hyperprolaktinämie, Gelbkörperinsuffizienz, immunologische Fehlregulation, Autoantikörper und eine veränderte Zusammensetzung der Bauchhöhlenflüssigkeit mit vermehrten aktivierten Makrophagen, Zytokinen, Prostaglandinen sein.[56] Die operative Entfernung von Endometrioseherden bei Kinderwunschpatientinnen erhöht die Wahrscheinlichkeit einer spontanen Schwangerschaft. Bei Wiederauftreten einer Endometriose, insbesondere nach bereits mehreren operativen Eingriffen, ist die künstliche Befruchtung zur Erfüllung des Kinderwunsches einer erneuten Operation überlegen.[11]
Endometriose und Schwangerschaft
Bevor Medikamente wie GnRH-Analoga zur Verfügung standen, galt eine Schwangerschaft als natürliche Behandlungsmethode der Endometriose.[57] Eine Schwangerschaft gilt heute nur noch als ein möglicher korrigierender Faktor für die Weiterentwicklung der Endometriose. Es kommt zu einer 9 Monate dauernden Amenorrhoe und gegebenenfalls auch einem längeren Ausbleiben der Menstruationsblutung durch das Stillen (Laktationsamenorrhoe). Bei ausgetragener Schwangerschaft erfolgt eine ausgeprägte Dezidualisierung der Endometriose und nach der Geburt zu einer Apoptose. Eine Heilung der Endometriose durch eine Schwangerschaft ist nicht möglich.[10] Die Daten der Nurses’ Health Study II zeigten, dass Frauen, die länger gestillt haben, das Risiko einer Endometriose verringern.[58]
Andererseits scheint eine Endometriose einen negativen Einfluss auf eine Schwangerschaft zu haben, da Frauen mit Endometriose häufiger eine Präeklampsie, Blutungen in der Schwangerschaft, eine vorzeitige Plazentalösung, Placenta praevia, oder einen vorzeitigen Blasensprung bekommen. Das Risiko für kindliche Komplikationen, wie Frühgeburtlichkeit oder Wachstumsretardierung, ist erhöht.[59]
Endometriose bei Männern
In der Literatur werden seltene Einzelfälle von „Endometriosen“ bei Männern nach hochdosierter Hormongabe von Östrogenen, speziell zur Behandlung von Prostatakrebs, beschrieben.[60] Es handelt sich aber um endometriumähnliches Gewebe, speziell um endometriumähnliche Läsionen im Prostatagewebe. Erklärt wird dies durch Vorhandensein des Utriculus prostaticus, des Überrestes des embryonal angelegten Müller-Ganges beim Mann.
Endometriose bei Tieren

Eine Adenomyosis ist bei verschiedenen Säugetieren wie Pavianen,[62][63][64] Brazzameerkatzen,[65] Schimpansen,[66] Orang-Utans,[67] Rhesusaffen,[68] Hunden,[69][70] Katzen[71] und Mäusen[72] beschrieben worden. Die Endometriose an anderen Lokalisationen scheint jedoch auf Primaten beschränkt zu sein.[72][73]
Bei Primaten besteht nach einer Schnittentbindung das Risiko einer Endometriose in der Bauchhöhle durch verstreute Endometriumfragmente.[74] Tierexperimentelle Untersuchungen konnten nach Schnittentbindungen bei Schafen eine Adenomyosis in der Gebärmutternarbe nachweisen.[75]
Bei Pavianen wurde in Zusammenhang mit der Endometriose eine eingeschränkte Fruchtbarkeit gefunden.[76][77] Sie gelten daher als gutes Tiermodell für die Erforschung der Erkrankung und der damit verbundenen Fertilitätsprobleme beim Menschen.[61][78] Als weitere Tiermodelle werden Rhesusaffen[79] und Mäuse[72] genutzt.
Die bei Pferden und verschiedenen anderen Haustierarten bekannte Erkrankung Endometrose, eine chronisch-degenerative Erkrankung des Endometriums, steht in keinem Zusammenhang mit der Endometriose.[80][81]
Pathologie
Die Endometriose ist eine gutartige Erkrankung. Aufgrund des unterschiedlichen Verhaltens und unterschiedlicher Befunde bei der feingeweblichen Untersuchung wird die Endometrioseerkrankung in verschiedene Unterformen eingeteilt:[51][82]
- die Endometriose des Peritoneums
- die Endometriose der Eierstöcke
- die tiefe infiltrierende Endometriose
- die Adenomyosis
Außerdem unterscheidet man nach klinischen, feingeweblichen und gegebenenfalls biochemischen Gesichtspunkten in aktive und inaktive Endometrioseherde.[51]
| Makroskopie | |||
| Peritonealendometriose aktiv rote Herde bläschenförmige Auflagerungen |
Peritonealendometriose inaktiv schwarze, braune Herde weißliche Bauchfellverdickungen |
Ovarialendometriose aktiv dünnwandige Zysten bläulich, eingeblutet, rot |
Ovarialendometriose inaktiv dickwandige Zysten fibrotisch, braun, schwarz |
| Mikroskopie | |||
| Epithel aktiv endometrioid hoch differenziert hormonelle Veränderungen eutroph viele Mitosen |
Epithel inaktiv eingeengt, würfelförmig niedrig differenziert nicht hormonell verändert atrophisch einige/keine Mitosen |
Stroma aktiv Ödem, Entzündung Erythrozyten viele Kapillaren eutroph – |
Stroma inaktiv kondensiert, Fibrose Siderophagen wenige/keine Kapillaren kondensiert – |
| Biochemie | |||
| Nachweis von Antikörpern gegen körpereigenes (autologes) Endometrium | |||
Klinisches Erscheinungsbild
Bei einer Endometriose auf dem Bauchfell unterscheidet man zwischen roten, weißen und schwarzen Herden[84] bzw. zwischen pigmentierten und nicht pigmentierten (atypischen) Herden.[85][86] Die roten und nicht pigmentierten Herde werden als frühe Formen der Endometriose angesehen. Sie gelten als besonders aktiv, da sie ausgeprägte Zeichen der Zellproliferation aufweisen.[87] Die typischen blau-schwarzen Herde, meist mit einem weißen Saum, sind eher alte und meist nicht mehr aktive Befunde.[51]
-
Blau-schwarze Herde mit weißlichen narbigen Veränderungen
-
Roter Endometrioseherd
-
Unpigmentierter weißer Herd
-
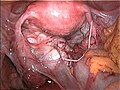
Endometriose des rechten Eierstocks
In der Gebärmuttermuskulatur stimuliert die Endometriose eine Hyperplasie der Muskulatur, so dass die Wanddicke der Gebärmutter zunimmt. Außerdem kommt es zur Bildung kleiner zystischer Hohlräume. Aufgrund dieser Reaktion wird die Erkrankung hier Adenomyosis genannt. Dabei können Endometrioseherde auch in Myomen vorkommen, die dann Adenomyome genannt werden.[88]
In den Eierstöcken bilden sich über einen längeren Zeitraum ebenfalls zystische Hohlräume. Diese werden Endometriome oder auch, nach dem Inhalt (eingedicktes altes Blut), als Teer- oder Schokoladenzysten bezeichnet. Dabei handelt es sich eigentlich um eine oberflächliche Endometriose, bei der sich zunächst ein Endometrioseherd an der Oberfläche bildet, welcher sich nach und nach in den Eierstock einstülpt.[51]
-
Eröffnete Endometriosezyste des linken Eierstocks
-
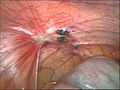
Endometriose auf dem Bauchfell zwischen Blase und Gebärmutter
-
Massive Verwachsungen bei Endometriose
-
Adenomyosis uteri
Bei der tiefen infiltrierenden Endometriose finden sich ausgeprägte knotige Veränderungen, insbesondere im Bereich der Bänder, wie dem Ligamentum sacrouterinum, sowie im Spatium rectovaginale zwischen Scheide und Enddarm. Diese Veränderungen können in umliegende Organe, wie die Harnblase und das Rektum, sowie tief in das Retroperitoneum hineinwachsen. Dabei kann es bei einer ausgeprägten retroperitonealen Endometriose zu einer Einengung der Harnleiter mit einem Stau des Urins bis hin zur Hydronephrose kommen.[51]
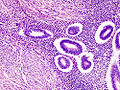
Mikroskopisches Bild
Feingeweblich finden sich kleine Gewebeinseln, die aus Stroma bestehen und typische endometriale Drüsen einschließen. Das Drüsengewebe kann dabei hormonelle Veränderungen wie an der normalen Gebärmutterschleimhaut aufweisen.[88] Außerdem können sich Hämosiderin-beladene Makrophagen, sogenannte Siderophagen, finden.[51]
-
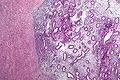
Endometriom im mikroskopischen Bild
-
Endometriose des Eierstocks im mikroskopischen Bild
-
Adenomyosis uteri im mikroskopischen Bild
Bei der Adenomyosis finden sich endometriales Stroma und Drüsen in die glatte Muskulatur der Gebärmutterwand eingelagert.
Glatte und quergestreifte Muskelzellen lassen sich, neben Stroma und Drüsen in den Herden bei der tiefen infiltrierenden Endometriose nachweisen. Diese Herde weisen ausgeprägte proliferative Eigenschaften, dagegen nur geringe hormonelle Veränderungen auf.[51]
Eine Arbeitsgruppe der Johns Hopkins University School of Medicine in Baltimore berichtete nach der Exom-Analyse von Herden tiefer infiltrierender Endometriose von 24 Frauen über somatische Mutationen in den Zellen der Läsionen bei einem Großteil der Frauen.[89]
Bösartige Endometriose-assoziierte Erkrankungen
Die Veränderung einer Endometriose in eine bösartige Erkrankung ist möglich, aber extrem selten und betrifft dann meist die Eierstöcke.[11] Sie werden häufig früher als andere Eierstockkrebserkrankungen erkannt und weisen meist einen höheren Differenzierungsgrad als diese auf. Sie werden dann wie Eierstockkrebs behandelt, wobei ein schlechteres Ansprechen auf eine Chemotherapie angenommen wird.[90]
Die häufigsten Lokalisationen außerhalb des Genitale sind der Mastdarm, das Colon sigmoideum und das Septum rectovaginale. Die Therapie besteht hier in der Resektion möglichst im Gesunden sowie einer anschließenden Strahlentherapie.[90]
Im Rahmen einer klimakterischen Hormonersatztherapie stellt eine Östrogenmonotherapie bei Endometriosepatientinnen einen potenziellen Risikofaktor für das Auftreten solch bösartiger Erkrankungen dar und wird daher nicht empfohlen.[90]
Klassifikation
Die Klassifizierung der Endometriose wird uneinheitlich gehandhabt. Es wurden viele verschiedene Schemata entwickelt, um eine Vergleichbarkeit der Befundausprägung zu ermöglichen. Dabei werden meist die Lokalisation, die Ausdehnung bzw. die Größe der Herde sowie die endometriosebedingten Folgeschäden als Kriterien herangezogen. Bislang genügt keine der Stadieneinteilungen allen Ansprüchen. Insbesondere besteht keine Übereinstimmung zwischen Stadium und bestehenden Beschwerden der Patientin.[51]
Einteilung nach der Lokalisation
Nach der Lokalisation der Herde wird die Endometriose in drei Formen unterteilt:[91]
- Endometriosis genitalis interna: Endometrioseherde innerhalb des Myometrium (auch Adenomyosis uteri)
- Endometriosis genitalis externa: Endometrioseherde außerhalb des Uterus im kleinen Becken (Ovarien, Ligamenta sacrouterina, Douglas, Blasenperitoneum)
- Endometriosis extragenitalis: Endometrioseherde außerhalb des kleinen Becken
Stadieneinteilung
Am weitesten verbreitet ist heute die Einteilung der American Society for Reproductive Medicine (sogenannte rASRM- oder früher AFS-Stadieneinteilung). Sie hat sich international durchgesetzt und arbeitet mit einem Punktesystem, nach welchem in vier Stadien/Schweregrade von leicht bis schwer unterschieden wird, sowie der zusätzlichen Beschreibung der Aktivität der Endometrioseherde.[84] Allerdings berücksichtigt sie extragenitale Formen der Krankheit nicht, wie es die ältere EEC (Endoscopic Endometriosis Classification)-Stadieneinteilung tut, die auf Kurt Semm zurückgeht und auf einer rein beschreibenden Einschätzung basiert. Auch sie unterteilt in vier Stadien. Die WHO-Klassifikation entspricht dieser Stadieneinteilung. Da die Beschreibung von retroperitonealen und tiefen infiltrierenden Wachstumsformen der Endometriose in allen bislang verwendeten Stadieneinteilungen nicht ausreichend ist, wurde die ENZIAN-Klassifikation entwickelt. Sie versucht, in Analogie zu den onkologischen Stadieneinteilungen des TNM- oder FIGO-Systems, die Erkrankung ebenfalls in vier Schweregrade einzuteilen. Die Abgrenzung der Stadien ergibt sich aus der Ausdehnung der Erkrankung bezogen auf die Fläche und die Tiefe.[92][93] Zur Beurteilung der Chancen auf eine Schwangerschaft bei Endometriose wurde der Endometriosis fertility index (EFI) entwickelt, der, neben der Endometrioseklassifikation nach rASRM, auch die funktionellen Einschränkungen, das Alter der Frau, die Dauer des unerfüllten Kinderwunsches und frühere Schwangerschaften in die Auswertung einbezieht.[29][94] Bei der STCDAP-Klassifikation (Subtle-Typical-Cystic-Deep-Adenomyosis-Pockets) werden zarte, typische und zystische Herde, eine tiefe Endometriose, die Adenomyosis sowie Peritonealtaschen separat klassifiziert.[95]
| WHO[96] / EEC[97] | rASRM[97][84] | ENZIAN[29] | EFI[29][94] | |
| Kriterien |
|
|
|
|
| Einbeziehung extragenitaler Befunde | ja | nein | ja | nein |
| Beurteilung der tiefen infiltrierenden Endometriose | nein | nein | ja | nein |
| Beurteilung der Aktivität | nein | nur durch makroskopische Beschreibung der Herde | nein | nein |
| Einschätzung der Schwangerschaftschancen | nein | nein | nein | ja |
Diagnose
Der Verdacht, dass eine Endometriose vorliegen könnte, ergibt sich häufig nach einer genauen Anamnese zum Auftreten und dem Charakter der Schmerzen[10] sowie bei Erkrankungen von nahen Verwandten.[12]
In die Differenzialdiagnosen muss eine Vielzahl von Erkrankungen aus dem Bereich der Gynäkologie, Gastroenterologie und Urologie einbezogen werden.[10]
| Gynäkologische Erkrankungen | Gastroenterologische Erkrankungen | Urologische Erkrankungen |
|---|---|---|
|
Durch die manuelle Untersuchung des Beckens (vaginal, rektal, rektovaginal) können nur größere Endometrioseherde aufgedeckt werden. Kolposkopisch lassen sich Herde an der Vulva, in der Scheide und am äußeren Muttermund betrachten.[10]

Durch eine transvaginale Ultraschalluntersuchung können große Endometrioseherde entdeckt werden. Bei Verdacht auf einen Befall des Enddarms kann eine zusätzliche transrektale Ultraschalluntersuchung hilfreich sein. Zur Klärung der Ausdehnung einer tiefen infiltrierenden Endometriose kann in Einzelfällen eine Magnetresonanztomographie beitragen. Die Krankheit kann dadurch aber bei negativem Befund der bildgebenden Verfahren nicht ausgeschlossen werden.[10]
Die Bestimmung von CA-125 im Blut ist als Diagnostik aufgrund einer unzureichenden Spezifität nicht sinnvoll und auch in der Verlaufskontrolle nur bedingt geeignet.[3][11][40]
Der Nachweis einer Endometriose der Bauchhöhle kann nur mit einer Bauchspiegelung erfolgen. Dabei werden die Herde visuell eingeschätzt und zur feingeweblichen Sicherung ganz oder teilweise entnommen.[11][40]
Die 2009 veröffentlichte Methode der Untersuchung von Gebärmutterschleimhautproben auf bestimmte Nervenfasern, die nur oder nur in großen Mengen bei Frauen mit einer Endometriose vorkommen, ist derzeit noch keine etablierte Diagnosemethode.[98][99][100] 2011 beschrieben britische Forscher Profile von Eiweißen im Urin, die möglicherweise einmal zur Diagnosestellung und Einschätzung der Schwere der Erkrankung genutzt werden können.[101]
Therapie
Ziel der Behandlung einer Endometriose ist die Verbesserung der Lebensqualität durch Beseitigung von Schmerzen, die Beseitigung von Funktionsstörungen betroffener Organe und die erfolgreiche Behandlung von Unfruchtbarkeit (Sterilität, Infertilität).[25] Dabei unterscheidet man die symptomatische Behandlung (Schmerzbehandlung), die operative und medikamentöse Therapie und die Anwendung komplementärer Therapieformen.[102] Trotz der Tatsache, dass seit 2012 an vielen neuen Wirkstoffen für die Behandlung der Endometriose geforscht wurde, gab es in den zehn Jahren bis 2022 keine signifikanten Fortschritte. Wissenschaftler betonen dementsprechend die Dringlichkeit der Entwicklung neuer, lindernder oder heilender Wirkstoffe für Endometriose.[103]
Operative Therapie


Das Ziel der operativen Behandlung ist, möglichst alle Endometrioseherde durch Ausschneiden (Exstirpation) zu entfernen oder sicher mit Hitze (Elektrokauterisation, Laserchirurgie) zu zerstören und die anatomischen Verhältnisse möglichst wiederherzustellen. Schokoladenzysten in den Eierstöcken sollten, unter Erhalt der Eierstöcke, ausgeschält werden.[11][102] Zusätzlich können hierbei eventuell vorhandene Verwachsungen gelöst und bei Kinderwunsch die Durchgängigkeit der Eileiter mittels Chromopertubation geprüft werden. Der Eingriff kann per Bauchspiegelung oder, besonders bei ausgedehnten Befunden, per Bauchschnitt durchgeführt werden.[34][51] Gerade bei oberflächlichen Endometrioseherden stellt die laparoskopisch chirurgische Therapie eine gut wirksame Behandlungsform dar.[104] Wiederholte chirurgische Eingriffe können dagegen einen Organverlust (z. B. Eierstock) nach sich ziehen und iatrogen, durch Narbenbildung und Verwachsungen, zusätzlich Schmerzen verursachen.[25]
Die Therapie der Wahl der symptomatischen tiefen infiltrierenden Endometriose ist eine vollständige Entfernung der Herde. Dies kann über eine vaginale Resektion, Laparoskopie, laparoskopisch-assistierte vaginale Operation oder per Bauchschnitt erfolgen. Bei Kinderwunsch ist durch den notwendigen Erhalt der Gebärmutter unter Umständen nur eine unvollständige Resektion der Endometriose möglich.[11]
Die Schmerzen und verlängerten bzw. verstärkten Blutungen, die von einer diffusen Endometriose in der Gebärmuttermuskulatur (Adenomyosis uteri) ausgehen, können bei abgeschlossener Familienplanung mit einer Gebärmutterentfernung erfolgreich behandelt werden, wenn nicht weitere Ursachen für Beschwerden vorliegen.[11] Einzelne Adenomyome lassen sich operativ entfernen.[102]
Hinsichtlich der Auswirkungen der operativen Behandlung einer Endometriose auf die Erfüllung eines Kinderwunsches besteht unter Experten keine einheitliche Meinung. Für die laparoskopische Sanierung der peritonealen Endometriose scheint ein kleiner Benefit zu bestehen.[105] Die Exzision der rektovaginalen Endometriose scheint in Bezug auf die Verbesserung der Fertilität von zweifelhaftem Nutzen zu sein. Den größten Nutzen in Hinsicht auf die Schwangerschaftsentstehungsrate scheint die Exzision von Endometriomen der Eierstöcke zu haben.[106][107][108]
| ESHRE 2005 | |
| Endometriose Grad I/II | begrenzter Nutzen, Chirurgie empfohlen |
| Endometriose Grad III/IV | möglicher, aber unbewiesener Nutzen, Chirurgie empfohlen |
| Endometriomentfernung vor IVF | empfohlen, wenn das Endometriom >4 cm groß ist |
| Rezidivendometriose | keine Empfehlungen |
| ASRM 2004 | |
| Endometriose Grad I/II | geringer Nutzen, Chirurgie empfohlen |
| Endometriose Grad III/IV | möglicher Nutzen, Chirurgie empfohlen |
| Endometriomentfernung vor IVF | zweifelhafter Nutzen, keine Empfehlungen |
| Rezidivendometriose | nicht empfohlen |
| RCOG 2006 | |
| Endometriose Grad I/II | nachgewiesener Nutzen, Chirurgie empfohlen |
| Endometriose Grad III/IV | möglicher Nutzen, Empfehlung unsicher |
| Endometriomentfernung vor IVF | empfohlen, wenn das Endometriom >4 cm groß ist |
| Rezidivendometriose | keine Empfehlungen |
Medikamentöse Therapie
Operative Maßnahmen zur Sicherung der Verdachtsdiagnose, insbesondere bei Kinderwunsch und bei Verdacht auf Endometriom, sind der Therapieschritt der ersten Wahl. Medikamentöse Behandlungsstrategien können zusätzlich, alternativ, aber auch als Langzeitkonzept sinnvoll sein, um Beschwerden zu lindern bzw. ein Wiederauftreten der Erkrankung zu vermeiden.[25] Dabei ist grundsätzlich eine symptomatische Behandlung des Schmerzes von einer Therapie zu unterscheiden, die direkt oder indirekt auf die Endometriose einwirkt.[102]
Zur Behandlung der Schmerzen werden Schmerzmittel wie Acetylsalicylsäure, Ibuprofen, Diclofenac, Naproxen oder Indometacin angewendet.[102]
Eine Einwirkung auf die Endometriose kann hormonell durch einphasige Östrogen-Gestagen-Kombinationspräparate („Pille“), reine Gestagene, wie Medroxyprogesteronacetat, Cyproteronacetat, Chlormadinonacetat, Levonorgestrel und Dienogest, sowie GnRH-Analoga erreicht werden.[102] Der Testosteronabkömmling Danazol ist ebenfalls effektiv in der Behandlung der Endometriose,[109] wurde in Deutschland 2005 wegen eines ungünstigen Nutzen-Risiko-Verhältnisses aber vom Markt genommen.[102]
Östrogen-Gestagen-Kombinationen führen bei kontinuierlicher Einnahme ohne Pause („Langzyklus“) zu einer Rückbildung der Gebärmutterschleimhaut und deutlichen Schmerzminderung bei Endometriose. Feingewebliche Nachweise der Wirkungen an den Herden fehlen jedoch.[102]
Reine Gestagene führen bei kontinuierlicher Anwendung durch eine Hemmung der Hypothalamus-Hypophysen-Ovar-Achse zu einer Blockade der Eierstockfunktion und damit im optimalen Fall zu einer Amenorrhoe. Damit kommt es zu einer Besserung der Schmerzen, einer Rückbildung bzw. Hemmung des Wachstums oder der Neubildung der Endometriose. Sie können auch in Form einer Minipille, der 3-Monats-Spritze oder der Hormonspirale verabreicht werden.[102]
GnRH-Analoga unterdrücken ebenfalls die Hypothalamus-Hypophysen-Ovar-Achse und führen damit zu einer Senkung des Östradiol-Spiegels mit einem Ausbleiben der Regelblutung nach den ersten 4 Wochen. Es kommt dabei zu typischen klimakterischen Beschwerden, wie Hitzewallungen und Schlafstörungen. Eine deutliche Verringerung der Knochendichte (Osteoporose) tritt bei einer Langzeitbehandlung auf. Mittels einer sogenannten Add-back-Behandlung mit begleitender Gabe von Gestagenen oder Östrogen-Gestagen-Kombinationen können die Beschwerden und der Verlust an Knochenmasse ausgeglichen werden, ohne die Effektivität auf die Endometriosebehandlung messbar zu beeinflussen.[102] Die Dauer der GnRH-Analoga-Behandlung ist dabei auf etwa sechs Monate begrenzt.[11] Sie ist die derzeit effektivste medikamentöse Behandlungsart und führt in höheren Stadien auch zu einer Steigerung der Erfolgsrate bei Kinderwunschbehandlungen.[102] Bei Eierstockendometriomen ist die alleinige medikamentöse Behandlung nicht ausreichend. Eine GnRH-Analogon-Gabe vor Operationen kann zur Verkleinerung des Endometrioms führen. Ob dadurch die Operation erleichtert wird oder die Rezidivraten vermindert werden, wird in der Fachliteratur kontrovers diskutiert. GnRH-Analoga nach der Operation einer Endometriosezyste kompensieren eine unvollständige Operation nicht. Ebenso ist der Nutzen einer prä- oder postoperativen GnRH-Analoga-Therapie bei tiefer infiltrierender Endometriose nicht belegt.[11]
Eine Behandlung mit GnRH-Antagonisten, Aromatasehemmern, COX-2-Hemmern, selektiven Progesteronrezeptormodulatoren und Östrogenrezeptor-β-Agonisten zur Behandlung der Endometriose ist derzeit noch in Erprobung.[102]
Komplementäre Behandlung
Komplementäre Behandlungsansätze können die operative und medikamentöse Therapie unterstützen.[110] Evidenzbasierte Belege für ihre Wirksamkeit liegen jedoch nicht vor.[55][111] Im Rahmen der Ordnungstherapie sollte zu mehr körperlicher Bewegung animiert, sollten Entspannungsverfahren und Meditationstechniken vermittelt werden.[33] Bewegungstherapie, Massage, Moorbäder und Yoga gelten als gute Maßnahmen einer symptomatischen Behandlung der Dysmenorrhoe.[32]
Durch eine Ernährungsumstellung kann das Leiden eventuell gelindert werden.[33] Dabei soll es helfen, auf Milch, Milchprodukte und Weizen zu verzichten, viel frisches Obst und Gemüse, kaltgepresste Öle, wie Nachtkerzenöl, Leinöl, Olivenöl, dazu fetten Seefisch (Omega-3-Fettsäuren) zu essen.[112][113]
Weitere Möglichkeiten der Behandlung sind die Physikalische, Enzym-, mikrobiologische und Phytotherapie, die Akupunktur, die Neuraltherapie und die Traditionelle chinesische Medizin.[32][33][110][114] Übergewicht sollte reduziert und das Tabakrauchen aufgegeben werden.[32]
Prognose
Die Endometriose ist eine chronische Erkrankung mit einer hohen Rezidivrate. Unabhängig von der ursprünglichen Behandlung, sei es als operative Sanierung, medikamentöse Unterdrückung der Eierstockfunktion oder Kombination aus operativer und medikamentöser Behandlung, wird über stadienabhängige Rezidivraten zwischen 20 und 80 % berichtet.[115] Rezidive lassen sich insbesondere nach dem Absetzen einer medikamentösen Behandlung nicht verhindern. Sie lassen sich lediglich um den Zeitraum der hormonellen Behandlung aufschieben.[116] Eine drei- bis sechsmonatige medikamentöse Behandlung mit GnRH-Analoga nach einer Operation erhöht zudem die Chancen einer Kinderwunschbehandlung, allerdings nur in den Stadien III und IV (nach rASRM).[117] Hinsichtlich des Nutzens der operativen Behandlung einer Endometriose für die Erfüllung des Kinderwunsches besteht unter Experten keine einheitliche Meinung.
Geschichte
Die älteste bekannte Beschreibung der Erkrankung ist die medizinische Doktorarbeit Disputatio Inauguralis Medica de Ulceribus Uteri des deutschen Arztes Daniel Schrön aus dem Jahre 1690. In ihr beschrieb er „Geschwüre“, die im gesamten Bauch, zwischen Blase, Darm und Ligamentum latum zu erheblichen Verwachsungen führen.[118]
1860 beschrieb Carl von Rokitansky (1804–1878) die Erkrankung und etablierte sie damit in der modernen Medizin. Aufgrund des gemeinsamen Vorkommens von Gebärmutterschleimhautanteilen und glatter Muskulatur nannte er die Befunde Adenomyome.[5][119] Hermann Löhlein teilte 1889 seine Beobachtung einer „adenomatösen Erkrankung des Corpus uteri mit multipler Zystenbildung in der Korpuswand“ der Gesellschaft für Geburtshilfe und Gynäkologie in Berlin mit.[120] Viele Jahre hielt man die Adenomyome und die eingebluteten Eierstockzysten für unterschiedliche Krankheitsbilder.
Im Jahr 1896 hatten bereits Friedrich von Recklinghausen und Hermann Wolfgang Freund (1859–1925) Befunde der Endometriose beobachtet.[121] Der kanadische Gynäkologe Thomas Stephen Cullen (1868–1953) beschrieb 1896 Endometrioseherde des Ligamentum rotundum und erkannte die gemeinsame Ursache der Krankheitsbilder.[122] Johannes Pfannenstiel (1862–1909) beschrieb 1897 als Erster die Endometriose im Septum rectovaginale.[10]
Der deutsche Gynäkopathologe Robert Meyer beschrieb 1903 die Narbenendometriose und 1909 die Endometriose im Colon sigmoideum, einem Dickdarmabschnitt, und in Lymphknoten. 1919 entwickelte er die Metaplasietheorie der Entstehung der Erkrankung.[123]
Der amerikanische Gynäkologe John A. Sampson (1873–1946) führte für pathologische Bildungen im Eierstock und im Bauchfell, an denen die Gebärmutterschleimhaut beteiligt ist, die Bezeichnung „endometrialer Typ“ ein, woraus der Begriff Endometriom entstand.[124] Sampson entwickelte 1921 die Transplantationstheorie und 1927 den Begriff Endometriose.[122][125] Der Österreicher Oskar Frankl führte 1925 den Begriff der Adenomyosis ein[122] und stellte 1929 dar, dass auch in den Eileitern eine Endometriose, die er Adenomyosis tubae nannte, vorkommt. Eine entzündliche Ursache für die Verdickung der gebärmutternahen Eileiteranteile, welche bis dahin angenommen und die Erscheinung daher als Salpingitis isthmica nodosa bezeichnet wurde, schloss er aus.[126] Der von Sampson geprägte Begriff Endometriose setzte sich erst bis 1932 endgültig durch.[127]
Der französische Staatspräsident Emmanuel Macron kündigte am 11. Februar 2022 eine nationale Strategie zur Bekämpfung der Endometriose an. Die Strategie sieht eine Vorreiterrolle Frankreichs in der Forschung und Innovation vor. Landesweit soll eine schnelle Diagnose und ein Zugang zu hochwertiger Versorgung gewährleistet werden und die Gesellschaft besser über diese Krankheit informiert und unterrichtet werden.[128][129]
Im Oktober 2024 wurde mit Förderung des Bundesministerium für Bildung und Forschung ein Projekt gestartet, in dem in einem Konsortium der medizinischen Einrichtungen der Universitäten Düsseldorf, Duisburg-Essen, Münster sowie der Medizinischen Hochschule Hannover die Entstehung von Endometriose erforscht werden soll. Federführend ist dabei das Endometriose-Zentrum des Universitätsklinikum Düsseldorf unter Leitung von Tanja Fehm.[130]
Wirtschaftliche Bedeutung
Die Endometriose hat durch medizinischen Aufwand und Arbeitsausfall eine erhebliche volkswirtschaftliche Bedeutung.[13][11] Die durch Endometriose verursachten Kosten wurden 2002 in den USA auf 22 Milliarden US-Dollar geschätzt. Dem stehen Kosten durch Morbus Crohn in Höhe von 865 Millionen USD und durch Migräne von 13 bis 17 Milliarden USD gegenüber.[131] Laut Ergebnissen einer britischen Studie sind Patientinnen aufgrund erheblicher Beschwerden im Schnitt 45 Tage im Jahr arbeitsunfähig.[5] Frauen mit Endometriose haben jedoch, auch unabhängig vom Arbeitsausfall, schmerzbedingt eine erheblich verringerte Produktivität im Arbeitsleben. Dazu sind sie durch Schmerzen bei Tätigkeiten im Alltag beeinträchtigt.[132] Auf der anderen Seite verursacht bei rund der Hälfte der Patientinnen die Endometriose keine oder nur geringe Beschwerden.[5]
Trotz der hohen Zahl von geschätzten jährlich 40.000 neu erkrankten Frauen in Deutschland und ihrer damit zusammenhängenden hohen volkswirtschaftlichen Bedeutung ist die Erkrankung in der klinischen und basiswissenschaftlichen Forschung bislang verhältnismäßig wenig vertreten.[11] Nach Medienangaben (Stand: 2022) beträgt die Forschungsförderung aus deutschen Bundesmitteln jährlich durchschnittlich circa 25.000 Euro.[133]
Organisationen
International wurden verschiedene Organisationen gegründet, um verstärkt auf die Erkrankung aufmerksam zu machen und Forschung und Weiterbildung zu unterstützen.
Die World Endometriosis Society (WES) wurde 1998 gegründet und fördert den Wissensaustausch zwischen Wissenschaftlern unterschiedlicher Fachrichtungen. Sie veranstaltet regelmäßig den World Congress on Endometriosis.[134]
Zur Förderung der Forschung auf dem Gebiet der Endometriose wurde 2006 die World Endometriosis Research Foundation (WERF) gegründet, in welcher die Special Interest Group for Endometriosis & Endometrium (SIGEE) der European Society of Human Reproduction and Embryology (ESHRE), die Endometriosis Special Interest Group (EndoSIG) der American Society for Reproductive Medicine (ASRM) und der World Endometriosis Society zusammenarbeiten.[135]
Im September 2005 wurde die Europäische Endometriose Liga (EEL) gegründet. Der EEL angeschlossen ist die Stiftung Endometriose-Forschung (SEF), welche die Arbeit der EEL durch die Organisation von gemeinsamen Tagungen, Seminaren, Fortbildungsveranstaltungen und Kongressen zu den Themen Endometriose, Schmerzen und Unfruchtbarkeit unterstützt. Der Endometriose-Kongress Deutschsprachiger Länder findet alle zwei Jahre statt.
Zusammen mit der Endometriose-Vereinigung-Deutschland e. V. (EVD) einer deutschlandweiten Selbsthilfeorganisation, zertifizieren die EEL und die SEF Endometriose-Zentren zur Verbesserung der Diagnostik und Behandlung der Erkrankung.[21][136][137][138] Die EVD wurde 1996 gegründet und hat deutschlandweit über 3.000 Mitglieder (Stand Juli 2022). Die Kernaufgaben des Vereins sind die breite Aufklärung über Endometriose, die Beratung von Betroffenen und ihren Angehörigen sowie die Stärkung der Teilhabe von Betroffenen in Politik und Gesellschaft.[139]
Jährlich findet in der zweiten Märzwoche international eine Endometriosis Awareness Week statt, um auf das Krankheitsbild aufmerksam zu machen.[140] Der 29. September ist „Tag der Endometriose“, ein nationaler Aktionstag zur Aufklärung über Endometriose in Deutschland.[141]
Literatur
Fachliteratur
- Journal of Endometriosis and Pelvic Pain Disorders, ISSN 2036-282X, Wichtig Editore Verlag, Mailand (Italien)
- Thomas Steck, Ricardo Felberbaum, Wolfgang Küpker, Cosima Brucker, Dominique Finas: Endometriose. Springer, 2004, ISBN 3-211-00746-6 (eingeschränkte Vorschau in der Google-Buchsuche).
- Thomas Römer und Andreas D. Ebert (Hrsg.): Endometriose: Ein Wegweiser für die Praxis. 5. Auflage. Walter de Gruyter, 2019, ISBN 978-3-11-055978-1 (eingeschränkte Vorschau in der Google-Buchsuche).
- Liselotte Mettler: Endometriose. pmi Verlag, Frankfurt am Main, 2000, ISBN 3-89786-022-8.
- R. W. Shaw: An Atlas of Endometriosis. Parthenon Publishing Group, Carnforth-Pearl River 1993.
- Gülden Halis et al.: Diagnose und Therapie der tief-infiltrierenden Endometriose. In: Dtsch Arztebl Int. Nr. 107(25), 2010, S. 446–455, doi:10.3238/arztebl.2010.0446.
Leitlinien
- S2k-Leitlinie Diagnostik und Therapie der Endometriose der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG). In: AWMF online (Stand 9/2020)
- Christian M. Becker et al.: ESHRE guideline: endometriosis. In: Human Reproduction Open. Band 2022, Nr. 2, 2022, S. hoac009, doi:10.1093/hropen/hoac009, PMID 35350465, PMC 8951218 (freier Volltext) – (englisch).
Weblinks
- Endometriose – Informationen bei Gesundheitsinformation.de (Online-Angebot des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen)
- Endometriose-im-Netz.de – Über das Leben mit Endometriose und der medizinischen Versorgung
- Endometriosis.org – englischsprachige peer reviewed Informationsplattform
- Jessica Papic: Endometriose verstehen. Ihr Wegweiser durch die Erkrankung. Auf: www.medisiegel.de, hrsg. von Danny Jazmati und Andreas Büchert.
- Was ist Endometriose und wie entsteht sie? (Abschnitt Ursachen.) – Informationsvideo des Bundesministeriums für Gesundheit, Dauer: 3:37 Minuten. Alternativlink auf Youtube
Organisationen
- Stiftung Endometrioseforschung
- EVA. Endometriosevereinigung Austria
- Endometriose-Vereinigung Deutschland
- Arbeitsgemeinschaft Endometriose
- Europäische Endometriose Liga
- World Endometriosis Society
- World Endometriosis Research Foundation
- Special Interest Group for Endometriosis and Endometrial Disorders (SIGEE) der European Society of Human Reproduction and Embryology (ESHRE)
- Endometriosis Special Interest Group (EndoSIG) der American Society for Reproductive Medicine (ASRM)
Einzelnachweise
- ↑ a b c Liselotte Mettler, A. Schmutzler; In: Klaus Diedrich, Wolfgang Holzgreve, Walter Jonat, Askan Schultze-Mosgau, Klaus-Theo M. Schneider: Gynäkologie und Geburtshilfe. Springer Verlag, 2006, ISBN 3-540-32867-X (Volltext in der Google-Buchsuche).
- ↑ Fritz Nagele: Endometriose – Ein unterschätztes Leid? In: J Gynäkol Endokrinol. 3, 2009, S. 45–46, kup.at (PDF; 343 kB)
- ↑ a b A. E. Schindler, P.-A. Regidor; In: J. W. Dudenhausen: Frauenheilkunde und Geburtshilfe. Walter de Gruyter, 2002, ISBN 3-11-016562-7 (Volltext in der Google-Buchsuche).
- ↑ a b c M. S. Arruda, C. A. Petta, M. S. Abrão, C. L. Benetti-Pinto: Time elapsed from onset of symptoms to diagnosis of endometriosis in a cohort study of Brazilian women. In: Hum Reprod. 18, 2003, S. 756–759. PMID 12660267, oxfordjournals.org
- ↑ a b c d e f g h i F. Oehmke, F. Suwandinata, C. Deisting, H. Tinneberg: Datenlage zur Endometriose. In: Gynäkologe. 40, 2007, S. 521–526 doi:10.1007/s00129-007-2015-6
- ↑ K. Yamamoto, Y. Mitsuhashi, T. Takaike, K. Takase, H. Hoshiai, K. Noda: Tubal endometriosis diagnosed within one month aftermenarche: a case report. In: Tohoku J Exp Med. 181, 1997, S. 385–387. PMID 9163854
- ↑ A. D. Ebert, N. Fuhr, M. David, L. Schneppel, T. Papadopoulos: Histological Confirmation of Endometriosis in a 9-Year-Old Girl Suffering from Unexplained Cyclic Pelvic Pain since Her Eighth Year of Life. In: Gynecol Obstet Invest. 67, 2008, S. 158–161. PMID 19077389
- ↑ a b H. Suginami: A reappraisal of the coelomic metaplasia theory by reviewing endometriosis occurring in unusual sites and instances. In: Am J Obstet Gynecol. 165, 1991, S. 214–218. PMID 1853899
- ↑ R. E. Batt, M. F. Mitwally: Endometriosis from thelarche to midteens: pathogenesis and prognosis, prevention and pedagogy. In: J Pediatr Adolesc Gynecol. 16, 2003, S. 337–347. PMID 14642954, doi:10.1016/j.jpag.2003.09.008
- ↑ a b c d e f g h i j k l m Adolf E. Schindler: Epidemiologie, Pathogenese und Diagnostik der Endometriose. In: J Fertil Reprod. 17, 2007, S. 22–27, kup.at (PDF; 387 kB)
- ↑ a b c d e f g h i j k l S2k-Leitlinie Endometriose: Diagnostik und Therapie der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe (DGGG). In: AWMF online (Stand 8/2013)
- ↑ a b c d S. Dogan, S. Djalali, A. Agic, K. Diedrich, D. Hornung: Diagnostik der Endometriose: Neue Tests aus peripherem Blut. In: J Gynäkol Endokrinol. 2, 2008, S. 14–17, kup.at (PDF; 263 kB)
- ↑ a b K. W. Schweppe: Endometriose – Eine Erkrankung ohne Lobby. In: Zentralbl Gynäkol. 125, 2003, S. 233.
- ↑ G. K. Husby, R. S. Haugen, M. H. Moen: Diagnostic delay in women with pain and endometriosis. In: Acta Obstet Gynecol Scand. 82, 2003, S. 649–653. PMID 12790847
- ↑ S. Luisi, L. Lazzeri, V. Ciani, F. Petraglia: Endometriosis in Italy: from cost estimates to new medical treatment. In: Gynecol Endocrinol. 11, 2009, S. 734–740. PMID 19908951
- ↑ G. Hudelist, N. Fritzer, A. Thomas, C. Niehues, P. Oppelt, D. Haas, A. Tammaa, H. Salzer: Diagnostic delay for endometriosis in Austria and Germany: causes and possible consequences. In: Hum Reprod. (2012). PMID 22990516, doi:10.1093/humrep/des316
- ↑ Nina Ayerle: Starke Schmerzen – schwere Diagnose: Rund jede zehnte Frau ist von Endometriose betroffen. In: Stuttgarter Nachrichten. Nr. 253, 31. Oktober 2019, S. 40.
- ↑ Ruth Hadfield, Helen Mardon, David Barlow, Stephen Kennedy: Delay in the diagnosis of endometriosis: a survey of women from the USA and the UK. In: Hum Reprod. 11, 1996, S. 878–880. PMID 8671344, oxfordjournals.org (PDF; 249 kB)
- ↑ Karen Ballard, Karen Lowton, Jeremy Wright: What’s the delay? A qualitative study of women’s experiences of reaching a diagnosis of endometriosis. In: Fertil Steril. 86, 2006, S. 1296–1301. PMID 17070183, doi:10.1016/j.fertnstert.2006.04.054
- ↑ a b M. L. Ballweg: Impact of endometriosis on women’s health: comparative historical data show that the earlier the onset, the more severe the disease. In: Best Pract Res Clin Obstet Gynaecol. 18, 2004, S. 201–218. PMID 15157638
- ↑ a b K. W. Schweppe, A. D. Ebert, L. Kiesel: Endometriosezentren und Qualitätsmanagement. In: Gynäkologe. 43, 2010, S. 233–240, doi:10.1007/s00129-009-2484-x
- ↑ S. Saberi, A. R. Farhoud, A. Radmehr: Calf endometriosis: a case report and review of musculoskeletal involvement. In: Am J Orthop (Belle Mead NJ). Band 38, 2009, S. E175–E178. PMID 20049359
- ↑ Wolfgang Kühn, Heinz Pickartz: Klinische Pathologie des weiblichen Genitale. Wissenschaftliche Verlagsanstalt, 2001, ISBN 3-8047-1778-0, S. 223.
- ↑ a b c d e F. Wieser, R. Wenzl, R. N. Taylor, K. Diedrich, D. Hornung: Genetik der Endometriose. In: Gynäkologe. 37, 2004, S. 676–680, doi:10.1007/s00129-004-1558-z
- ↑ a b c d e f g h W. Urdl: Der derzeitige Stand der konservativen Therapie der Endometriose. In: J Reproduktionsmed Endokrinol. 3, 2006, S. 24–30, kup.at (PDF; 940 kB)
- ↑ G. Leyendecker, G. Kunz, M. Noe, M. Herbertz, D. Beil, P. Huppert, G. Mall: Die Archimetra als neues morphologisch-funktionelles Konzept des Uterus sowie als Ort der Primärerkrankung bei Endometriose. In: Reproduktionsmedizin. 15, 1999, S. 356–371, doi:10.1007/s004440050126, oxfordjournals.org (PDF; 236 kB)
- ↑ G. Leyendecker, G. Kunz, M. Noe, M. Herbertz, G. Mall: Endometriosis: a dysfunction and disease of the archimetra. In: Hum Reprod Update. 4, 1998, S. 752–762. PMID 10027630
- ↑ G. Leyendecker, L. Wildt, G. Mall: Uterine peristaltic activity and the development of endometriosis. In: Ann N Y Acad Sci. 1034, 2004, S. 338–355. PMID 15731324, PMC 2730449 (freier Volltext)
- ↑ a b c d e f Jörg Keckstein, Gernot Hudelist, Frank Tuttlies, Uwe Ulrich: Update Endometrioseforschung. Neue Konzepte – neue Methoden. (PDF) Ehemals im (nicht mehr online verfügbar); abgerufen am 3. Dezember 2021. (Seite nicht mehr abrufbar. Suche in Webarchiven) In: gynäkologie + geburtshilfe. 2, 2010, S. 22–25
- ↑ Claire Templeman, Sarah F Marshall, Giske Ursin, Pamela L. Horn-Ross, Christina A. Clarke, Mark Allen, Dennis Deapen, Argyrios Ziogas, Peggy Reynolds, Rosemary Cress, Hoda Anton-Culver, Dee West, Ronald K. Ross, Leslie Bernstein: Adenomyosis and endometriosis in the California Teachers Study. In: Fertil Steril. 90, 2008, S. 415–424. PMID 17919609, doi:10.1016/j.fertnstert.2007.06.027, PMC 2813675 (freier Volltext)
- ↑ Ayako Muraoka et al., Science Translational Medicine, Vol. 15 (700) Fusobacterium infection facilitates the development of endometriosis through the phenotypic transition of endometrial fibroblasts
- ↑ a b c d e f g h Stefan Weinschenk: Endometriose, Dysmenorrhoe, Sterilität und vegetatives Nervensystem. In: EHK. 53, 2004, S. 1–9. natum.de ( des vom 4. März 2016 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (PDF; 1,7 MB)
- ↑ a b c d e Ingrid Gerhard, Marion Kiechle: Gynäkologie integrativ: konventionelle und komplementäre Therapie. Elsevier, Urban & Fischer, 2006, ISBN 3-437-56260-6 (Volltext in der Google-Buchsuche).
- ↑ a b c d e f g h i j k l m n o p q B. Hinney, G. Emons; In: Marion Kiechle: Gynäkologie und Geburtshilfe. Elsevier, Urban & Fischer-Verlag, 2006, ISBN 3-437-42406-8 (Volltext in der Google-Buchsuche).
- ↑ a b Grant W. Montgomery, Dale R. Nyholt, Zhen Zhen Zhao, Susan A. Treloar, Jodie N. Painter, Stacey A. Missmer, Stephen H. Kennedy, Krina T. Zondervan: The search for genes contributing to endometriosis risk. In: Hum Reprod Upd. 14, 2008, S. 447–457. PMID 18535005, doi:10.1093/humupd/dmn016
- ↑ K. A. Hansen, K. M. Eyster: Genetics and genomics of endometriosis. In: Clin Obstet Gynecol. 53, 2010, S. 403–412. PMID 20436317
- ↑ H. Cakmak, H. S. Taylor: Molecular mechanisms of treatment resistance in endometriosis: the role of progesterone-hox gene interactions. In: Semin Reprod Med. 28, 2010, S. 69–74. PMID 20104430
- ↑ a b c Thomas Steck, Ricardo Felberbaum, Wolfgang Küpker, Cosima Brucker, Dominique Finas: Endometriose. Springer-Verlag, 2004, ISBN 3-211-00746-6 (Volltext in der Google-Buchsuche).
- ↑ a b c d Andreas D. Ebert: Endometriose: Ein Wegweiser für die Praxis. Walter de Gruyter-Verlag, 2006, ISBN 3-11-018984-4 (Volltext in der Google-Buchsuche).
- ↑ a b c d Cynthia Farquhar: Endometriosis. In: BMJ. 334, 2007, S. 249–253. PMID 17272567, doi:10.1136/bmj.39073.736829.BE, PMC 1790744 (freier Volltext)
- ↑ U. R. Panganamamula, O. H. Harmanli, E. F. Isik-Akbay, C. A. Grotegut, V. Dandolu, J. P. Gaughan: Is prior uterine surgery a risk factor for adenomyosis? In: Obstet Gynecol. 104, 2004, S. 1034–1038. PMID 15516398
- ↑ F. Nawroth, D. Foth, T. Schmidt, R. Sudik, Th. Römer: Differenzialdiagnostische Probleme und Therapie der Narbenendometriose. In: Geburtsh Frauenheilk. 60, 2000, S. 496–498, doi:10.1055/s-2000-8031
- ↑ Mary L. Hediger, Heather J. Hartnett, Germaine M. Buck Louis: Association of endometriosis with body size and figure. In: Fertil Steril. 84, 2005, S. 1366–1374. PMID 16275231, doi:10.1016/j.fertnstert.2005.05.029, PMC 1343487 (freier Volltext)
- ↑ S. E. McCann, J. L. Freudenheim, S. L. Darrow, R. E. Batt, M. A. Zielezny: Endometriosis and body fat distribution. In: Obstet Gynecol. 82, 1993, S. 545–549. PMID 8377980
- ↑ L. B. Signorello, B. L. Harlow, D. W. Cramer, D. Spiegelman, J. A. Hill: Epidemiologic determinants of endometriosis: a hospital-based case-control study. In: Ann Epidemiol. 7, 1997, S. 267–274. PMID 9177109
- ↑ S. Bérubé, S. Marcoux, R. Maheux: Characteristics related to the prevalence of minimal or mild endometriosis in infertile women. Canadian Collaborative Group on Endometriosis. In: Epidemiology. 9, 1998, S. 504–510. PMID 9730028
- ↑ a b Irene Jiang, Paul J. Yong, Catherine Allaire, Mohamed A. Bedaiwy: Intricate Connections between the Microbiota and Endometriosis. In: International Journal of Molecular Sciences. Band 22, Nr. 11, Januar 2021, ISSN 1422-0067, S. 5644, doi:10.3390/ijms22115644 (mdpi.com [abgerufen am 7. Oktober 2023]).
- ↑ Khaleque N. Khan, Akira Fujishita, Koichi Hiraki, Michio Kitajima, Masahiro Nakashima, Shinji Fushiki, Jo Kitawaki: Bacterial contamination hypothesis: a new concept in endometriosis. In: Reproductive Medicine and Biology. Band 17, Nr. 2, 18. Januar 2018, ISSN 1445-5781, S. 125–133, doi:10.1002/rmb2.12083, PMID 29692669, PMC 5902457 (freier Volltext).
- ↑ M. Kaufmann, A. Pfleiderer: Tumoren und Veränderungen der weiblichen Geschlechtsorgane. In: M. Breckwoldt, M. Kaufmann, A. Pfleiderer (Hrsg.): Gynäkologie und Geburtshilfe. Stuttgart 2008, S. 205–208.
- ↑ A. Fauconnier, C. Chapron: Endometriosis and pelvic pain: epidemiological evidence of the relationship and implications. In: Hum Reprod Update. 11, 2005, S. 595–606. PMID 16172113, pdf oxfordjournals.org abgerufen am 29. Dezember 2008.
- ↑ a b c d e f g h i j R. Baumann In: Manfred Kaufmann, Serban D. Costa, Anton Scharl: Die Gynäkologie. Springer Verlag, 2005, ISBN 3-540-25664-4 (Volltext in der Google-Buchsuche).
- ↑ Wolfgang Janni: Facharzt Gynäkologie. Elsevier, Urban & Fischer Verlag, 2008, ISBN 3-437-23915-5 (Volltext in der Google-Buchsuche).
- ↑ American Society for Reproductive Medicine: Endometriosis and infertility. In: Fertil Steril. 86 (Suppl 4) (2006), S. S156–S160, asrm.org (PDF; 91 kB)
- ↑ U. Ulrich, F. Müller, F. Tuttlies, J. Keckstein: Diagnostik und Therapie der Endometriose – aktuelle Entwicklungen. In: Frauenarzt. 50, 2009, S. 506–510, online ( vom 4. März 2016 im Internet Archive) (PDF; 275 kB)
- ↑ a b Freimut Leidenberger, Thomas Strowitzki, Olaf Ortmann (Hrsg.): Klinische Endokrinologie für Frauenärzte. Springer Verlag, 2004, ISBN 3-540-89759-3 (Volltext in der Google-Buchsuche).
- ↑ Jörg Baltzer, Klaus Friese, Michael Graf, Friedrich Wolff: Praxis der Gynäkologie und Geburtshilfe: Das komplette Praxiswissen in einem Band. Georg Thieme Verlag, 2006, ISBN 3-13-144261-1 (Volltext in der Google-Buchsuche).
- ↑ Martin Sillem: Endometriose: gutartig, aber gemein. Die versteckte Krankheit erkennen und wirksam behandeln. TRIAS Ärztlicher Rat, 2003, ISBN 3-8304-3095-7 (Volltext in der Google-Buchsuche).
- ↑ Leslie V. Farland, A. Heather Eliassen, Rulla M Tamimi, Donna Spiegelman, Karin B. Michels, Stacey A. Missmer: History of breast feeding and risk of incident endometriosis: prospective cohort study. In: BMJ. 2017, S. 358, doi:10.1136/bmj.j3778. PMID 28851765, bmj.com (PDF; 476 kB)
- ↑ Janne Foss Berlac, Dorthe Hartwell, Charlotte Wessel Skovlund, Jens Langhoff-Roos, Øjvind Lidegaard: Endometriosis increases the risk of obstetrical and neonatal complications. In: Acta Obstet Gynecol Scand. 9. Feb 2017. PMID 28181672, doi:10.1111/aogs.13111
- ↑ Andreas D. Ebert: Endometriose bei Männern – nichts ist unmöglich? In: Thomas Römer und Andreas D. Ebert (Hrsg.): Endometriose. 5. Auflage. De Gruyter, 2019, ISBN 978-3-11-056132-6, S. 59, doi:10.1515/9783110561326-006.
- ↑ a b Julie M. Hastings, Asgerally T. Fazleabas: A baboon model for endometriosis: implications for fertility. In: Reprod Biol Endocrinol. 4 (2006) Suppl 1, S. S7. PMID 17118171, doi:10.1186/1477-7827-4-S1-S7
- ↑ C. M. Moore, G. B. Hubbard, M. M. Leland, B. G. Dunn, R. G. Best: Spontaneous ovarian tumors in twelve baboons: a review of ovarian neoplasms in non-human primates. In: J Med Primatol. 32, 2003, S. 48–56. PMID 12733602
- ↑ T. M. D’Hooghe, C. S. Bambra, B. M. Raeymaekers, P. R. Koninckx: Development of spontaneous endometriosis in baboons. In: Obstet Gynecol. 88, 1996, S. 462–466. PMID 8752259.
- ↑ T. M. D’Hooghe, C. S. Bambra, F. J. Cornillie, M. Isahakia, P. R. Koninckx: Prevalence and laparoscopic appearance of spontaneous endometriosis in the baboon (Papio anubis, Papio cynocephalus). Archiviert vom (nicht mehr online verfügbar) am 23. September 2015; abgerufen am 3. Dezember 2021. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Biol Reprod. 45, 1991, S. 411–416. PMID 1838282
- ↑ A. A. Binhazim, R. P. Tarara, M. A. Suleman: Spontaneous external endometriosis in a De Brazza’s monkey. In: J Comp Pathol. 101, 1989, S. 471–474. PMID 2607018
- ↑ Breton F. Barrier, Jana Allison, Gene B. Hubbard, Edward J. Dick Jr, Kathleen M. Brasky, Danny J. Schust: Spontaneous adenomyosis in the chimpanzee (Pan troglodytes): a first report and review of the primate literature: case report. In: Hum Reprod. 22, 2007, S. 1714–1717. PMID 17452396, (online)
- ↑ K. J. Graham, F. A. Hulst, L. Vogelnest, I. S. Fraser, C. M. Shilton: Uterine adenomyosis in an orang-utan (Pongo abelii/pygmaeus). In: Aust Vet J. 87, 2009, S. 66–69, 19178483.
- ↑ R. M. Hadfield, P. L. Yudkin, C. L. Coe, J. Scheffler, H. Uno, D. H. Barlow, J. W. Kemnitz, S. H. Kennedy: Risk factors for endometriosis in the rhesus monkey (Macaca mulatta): a case-control study. In: Hum Reprod Update. 3, 1997, S. 109–115. PMID 9286735
- ↑ H. Tamada, N. Kawate, T. Inaba, M. Kuwamura, M. Maeda, T. Kajikawa, T. Sawada: Adenomyosis with severe inflammation in the uterine cervix in a dog. In: Can Vet J. 46, 2005, S. 333–334. PMID 15943119, PMC 1082876 (freier Volltext)
- ↑ A. Newell-Fugate, E. Lane: Intrapartum uterine rupture with coincidental uterine adenomyosis in an African wild dog (Lycaon pictus). In: J Zoo Wildl Med. 40, 2009, S. 791–795. PMID 20063828
- ↑ J. Bulman-Fleming: A rare case of uterine adenomyosis in a Siamese cat. In: Can Vet J. 49, 2008, S. 709–712. PMID 18827849, PMC 2430406 (freier Volltext)
- ↑ a b c P. Greaves, I. N. White: Experimental adenomyosis. In: Best Pract Res Clin Obstet Gynaecol. 20, 2006, S. 503–510. PMID 16500151
- ↑ Breton F. Barrier, Edward J. Dick Jr, S. D. Butler, G. B. Hubbard: Endometriosis involving the ileocaecal junction with regional lymph node involvement in the baboon – striking pathological finding identical between the human and the baboon: A Case Report. In: Human Reproduction. 22, 2007, S. 272–274. PMID 16959811, doi:10.1093/humrep/del352
- ↑ Peter G. G. Jackson: Geburtshilfe in der Tiermedizin. Elsevier, Urban & Fischer Verlag, 2006, ISBN 3-437-57460-4 (Volltext in der Google-Buchsuche).
- ↑ A. Gül, Y. Simşek, S. Uğraş, T. Gül: Transverse uterine incision non-closure versus closure: an experimental study in sheep. In: Acta Obstet Gynecol Scand. 79, 2000, S. 813–817. PMID 11304961
- ↑ Breton F. Barrier, M. J. Malinowski, Edward J. Dick Jr, Gene B. Hubbard, G. W. Bates: Adenomyosis in the baboon is associated with primary infertility. In: Fertil Steril. 82 (2004) Suppl 3, S. 1091–1094. PMID 15474079
- ↑ T. M. D’Hooghe, C. S. Bambra, B. M. Raeymaekers, A. M. Riday, M. A. Suleman, P. R. Koninckx: The cycle pregnancy rate is normal in baboons with stage I endometriosis but decreased in primates with stage II and stage III–IV disease. In: Fertil Steril. 66, 1996, S. 809–813. PMID 8893690
- ↑ T. M. D’Hooghe: Clinical relevance of the baboon as a model for the study of endometriosis. In: Fertil Steril. 68, 1997, S. 613–625. PMID 9341599.
- ↑ T. M. D’Hooghe, C. M. Kyama, D. Chai, A. Fassbender, A. Vodolazkaia, A. Bokor, J. M. Mwenda: Nonhuman primate models for translational research in endometriosis. In: Reprod Sci. 16, 2009, S. 152–161. PMID 19208783
- ↑ Christine Aurich: Reproduktionsmedizin beim Pferd: Gynäkologie, Andrologie, Geburtshilfe. Thieme Verlag, 2005, ISBN 3-8304-4102-9 (Volltext in der Google-Buchsuche).
- ↑ C. Hoffmann, C. Ellenberger, R. C. Mattos, H. Aupperle, S. Dhein, B. Stief, H. A. Schoon: The equine endometrosis: new insights into the pathogenesis. In: Anim Reprod Sci. 111, 2009, S. 261–278. PMID 18468817
- ↑ M. Nisolle, J. Donnez: Peritoneal endometriosis, ovarian endometriosis, and adenomyotic nodules of the rectovaginal septum are three different entities. In: Fertil Steril. 68, 1997, S. 585–596. PMID 9341595.
- ↑ K. W. Schweppe: Aktive und inaktive Endometriose – eine prognose- und therapierelevante Differentialdiagnose. In: Zentralbl Gynäkol. 121, 1999, S. 330–335. PMID 10467688
- ↑ a b c American Society For Reproductive Medicine: Revised American Society for Reproductive Medicine classification of endometriosis. In: Fertility and Sterility. 67, 1997, S. 817–821, doi:10.1016/S0015-0282(97)81391-X. PMID 9130884
- ↑ R. P. Jansen, P. Russel: Nonpigmented endometriosis: clinical, laparoscopic, and pathological definition. In: Am J Obstet Gynecol. 155, 1986, S. 1154–1159. PMID 2947467
- ↑ M. Nisolle, B. S. Casanas-Roux, V. Anaf, J.-M. Mine, J. Donnez: Morphometric study of the stromal vascularization in peritoneal endometriosis. In: Fertil Steril. 59, 1993, S. 681–684. PMID 8458479
- ↑ J. Donnez, M. Nisolle, F. Casanas-Roux: Peritoneal endometriosis: two-dimensional and three dimensional evaluation of typical and subtle lesions. In: Ann NY Acad Sc. 734, 1994, S. 324–351. PMID 7978936
- ↑ a b Carlos Thomas: Spezielle Pathologie. Schattauer Verlag, 1996, ISBN 3-7945-2110-2 (Volltext in der Google-Buchsuche).
- ↑ Michael S. Anglesio u. a.: Cancer-Associated Mutations in Endometriosis without Cancer. In: N Engl J Med. 367, 2017, S. 1835–1848. doi:10.1056/NEJMoa1614814. PMID 28489996
- ↑ a b c U. Ulrich, O. Richter, E. Wardelmann, M. Valter, R. Schmutzler, M. Sillem, M. Possover, P. Mallmann: Endometriose und Malignom. In: Zentralbl Gynakol. 125, 2003, S. 239–242, doi:10.1055/s-2003-42277
- ↑ H. Albrecht Die Endometriose. In: Ludwig Seitz, Isidor Alfred Amreich (Hrsg.): Biologie und Pathologie des Weibes. Band IV. Verlag Urban & Schwarzenberg, Berlin / Innsbruck / München / Wien 1955, S. 190–288.
- ↑ F. Tuttlies, J. Keckstein, U. Ulrich, M. Possover, K. W. Schweppe, M. Wustlich, O. Buchweitz, R. Greb, O. Kandolf, R. Mangold, W. Masetti, K. Neis, G. Rauter, N. Reeka, O. Richter, A. E. Schindler, M. Sillem, V. Terruhn, H. R. Tinneberg: ENZIAN-score. Eine Klassifikation der tiefen infiltrierenden Endometriose. In: Zentralbl Gynäkol. 127, 2005, S. 275–281.
- ↑ F. Tuttlies, J. Keckstein, U. Ulrich, M. Possover, K. W. Schweppe, M. Wustlich, O. Buchweitz, R. Greb, O. Kandolf, R. Mangold, W. Masetti, K. Neis, G. Rauter, N. Reeka, O. Richter, A. E. Schindler, M. Sillem, V. Terruhn, H. R. Tinneberg: ENZIAN-Klassifikation zur Diskussion gestellt: Eine neue differenzierte Klassifikation der tief infiltrierenden Endometriose. In: J Gynäkol Endokrinol. 2, 2008, S. 6–13, online (PDF; 596 kB)
- ↑ a b G. David Adamson, David J. Pasta: Endometriosis fertility index: the new, validated endometriosis staging system. In: Fertil Steril. 2009 (Epub). PMID 19931076, doi:10.1016/j.fertnstert.2009.09.035, online (PDF; 780 kB)
- ↑ Philippe R. Kononckx, Anastasie Ussia, Leila Adamyan, Araud Wattiez: An endometriosis classification, designed to be evaluated. In: Gynecol Surg. 8, 2011, S. 1–6, doi:10.1007/s10397-010-0626-8
- ↑ Kay Goerke, Axel Valet: Kurzlehrbuch Gynäkologie und Geburtshilfe. Elsevier, Urban & Fischer Verlag, 2004, ISBN 3-437-42812-8 (Volltext in der Google-Buchsuche).
- ↑ a b Thomas Steck, Ricardo Felberbaum, Wolfgang Küpker, Cosima Brucker, Dominique Finas: Endometriose: Entstehung, Diagnose, Verlauf und Therapie. Springer Verlag, 2004, ISBN 3-211-00746-6 (Volltext in der Google-Buchsuche).
- ↑ Wucherung der Gebärmutterschleimhaut. Einfaches Diagnose-Verfahren entwickelt. In: Spiegel online. 19. August 2009; abgerufen am 27. April 2010.
- ↑ M. Al-Jefout, G. Dezarnaulds, M. Cooper, N. Tokushige, G. M. Luscombe, R. Markham, I. S. Fraser: Diagnosis of endometriosis by detection of nerve fibres in an endometrial biopsy: a double blind study. In: Hum Reprod. 24, 2009, S. 3019–3024, doi:10.1093/humrep/dep275
- ↑ A. Bokor, C. M. Kyama, L. Vercruysse, A. Fassbender, O. Gevaert, A. Vodolazkaia, B. De Moor, V. Fülöp, T. D’Hooghe: Density of small diameter sensory nerve fibres in endometrium: a semi-invasive diagnostic test for minimal to mild endometriosis. In: Human Reproduction. 24, 2009, S. 3025–3032, doi:10.1093/humrep/dep283
- ↑ Muna M. El-Kasti, Cynthia Wright, Haddy K.S. Fye, Fenella Roseman, Benedikt M. Kessler, Christian M. Becker: Urinary peptide profiling identifies a panel of putative biomarkers for diagnosing and staging endometriosis. In: Fertil Steril. 95, 2011, S. 1261–1266, doi:10.1016/j.fertnstert.2010.11.066
- ↑ a b c d e f g h i j k l A. E. Schindler: Operative und medikamentöse Therapie der Endometriose/Adenomyose. In: J Gynäkol Endokrinol. 18, 2008, S. 18–26, online (PDF; 461 kB)
- ↑ Vendy Zajec, Mislav Mikuš, Salvatore Giovanni Vitale, Maurizio Nicola D'alterio, Marija Gregov: Current status and challenges of drug development for hormonal treatment of endometriosis: a systematic review of randomized control trials. In: Gynecological Endocrinology: The Official Journal of the International Society of Gynecological Endocrinology. Band 38, Nr. 9, September 2022, ISSN 1473-0766, S. 713–720, doi:10.1080/09513590.2022.2109145, PMID 35971323.
- ↑ M. P. Radosa, T. S. Bernardi, I. Georgiev, H. Diebolder, O. Camara, I. B. Runnebaum: Coagulation versus excision of primary superficial endometriosis: a 2-year follow-up. In: Eur J Obstet Gynecol Reprod Biol. 150, 2010, S. 195–198. PMID 20303642, doi:10.1016/j.ejogrb.2010.02.022.
- ↑ T. Z. Jacobson, J. M. Duffy, D. Barlow, C. Farquhar, P. R. Koninckx, D. Olive: Laparoscopic surgery for subfertility associated with endometriosis. In: Cochrane Database Syst Rev. 2010, S. CD001398. PMID 20091519, doi:10.1002/14651858.CD001398.pub2.
- ↑ a b Patrick Imesch: Endometriose: richtiges operatives Vorgehen bei unerfülltem Kinderwunsch. online ( vom 4. März 2016 im Internet Archive) bei Universimed.com vom 27. Oktober 2010, abgerufen am 5. November 2010.
- ↑ R. J. Hart, M. Hickey, P. Maouris, W. Buckett: Excisional surgery versus ablative surgery for ovarian endometriomata. In: Cochrane Database Syst Rev. 2008, S. CD004992. PMID 18425908
- ↑ R. Hart, M. Hickey, P. Maouris, W. Buckett, R. Garry: Excisional surgery versus ablative surgery for ovarian endometriomata: a Cochrane Review. In: Hum Reprod. 20, 2005, S. 3000–3007. PMID 16246860, doi:10.1093/humrep/dei207
- ↑ V. Selak, C. Farquhar, A. Prentice, A. Singla: Danazol for pelvic pain associated with endometriosis. In: Cochrane Database Syst Rev. 17 (2007), S. CD000068. PMID 17943735
- ↑ a b Ergänzende Behandlung ( vom 19. Dezember 2017 im Internet Archive) bei der Europäischen Endometriose Liga
- ↑ A. Flower, J. P. Liu, S. Chen, G. Lewith, P. Little: Chinese herbal medicine for endometriosis. In: Cochrane Database Syst Rev. 8 (2009), S. CD006568. PMID 19588398
- ↑ Michael Vernon, Dian Shepperson Mills: Endometriosis: A Key to Healing And Fertility Through Nutrition. Thorsons, 2002, ISBN 0-00-713310-3.
- ↑ Nicole von Hoerschelmann: Endometriose – Schmerzfrei durch optimale Ernährung und einen gesundheitsfördernden Umgang mit Stress. Diametric Verlag, Würzburg 2011, ISBN 978-3-938580-21-9.
- ↑ Andreas A. Noll: Chinesische Medizin bei Fertilitätsstörungen: Erfolgreiche Behandlung bei unerfülltem Kinderwunsch. Georg Thieme Verlag, 2008, ISBN 978-3-8304-5355-0 (Volltext in der Google-Buchsuche).
- ↑ Karl-Werner Schweppe: Endometriose. Aktueller Stand von Diagnose und Therapie. In: Frauenarzt. 46, 2005, S. 373–381, frauenarzt.de ( vom 25. Januar 2016 im Internet Archive) (PDF; 345 kB)
- ↑ U. Geurts, P. Bung, J. Brökelmann: Therapie und Prognose der Endometriose. Langzeitergebnisse nach radikaler laparoskopischer Behandlung. In: Frauenarzt. 44, 2003, S. 268–273, frauenarzt.de ( vom 4. März 2016 im Internet Archive) (PDF; 270 kB)
- ↑ Frank Nawroth, Michael Ludwig: Endometriose. Postoperative Therapie zwischen aktueller Praxis und Evidenz. In: Frauenarzt. 46, 2005, S. 656–659, frauenarzt.de ( vom 4. März 2016 im Internet Archive) (PDF; 220 kB)
- ↑ Daniel Shroen: Disputatio inauguralis medica de ulceribus uteri. Dissertation. Universität Jena, 1690.
- ↑ Carl von Rokitansky: Über Uterusdrüsen – Neubildung in Uterus und Ovarialsarkomen. In: Ztsch K K Gesellsch der Ärzte zu Wien. 37, 1860, S. 577–581.
- ↑ Hans Albrecht: Die Endometriose. In: Biologie und Pathologie des Weibes. Hrsg. von Ludwig Seitz und Isidor Alfred Amreich, IV.1., Berlin, Innsbruck, München und Wien 1955.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 67.
- ↑ a b c G. Benagiano, I. Brosens: History of adenomyosis. In: Best Pract Res Clin Obstet Gynaecol. 20, 2006, S. 449–463. PMID 16515887
- ↑ Robert Meyer: Über den Stand der Frage der Adenomyositis und Adenome im allgemeinen und insbesondere über Adenomyositis seroepithelialis und Adenomyometritis sarcomatosa. In: Zbl Gynäkol. 43, 1919, S. 745–750.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 67.
- ↑ John A. Sampson: Peritoneal endometriosis due to the menstrual dissemination of endometrial tissue into the peritoneal cavity. In: Am J Obstet Gynecol. 14, 1927, S. 422–429.
- ↑ Oskar Frankl: Salpingitis isthmica nodosa und Adenomyosis tubae. In: Arch Gynecol Obstet. 135, 1929, S. 556–567, doi:10.1007/BF01702299
- ↑ Kathrin Beilecke, Andreas D. Ebert In: Ralf Tunn, Engelbert Hanzal, Daniele Perucchini: Urogynäkologie in Praxis und Klinik. Walter de Gruyter Verlag, 2009, ISBN 978-3-11-020688-3 (Volltext in der Google-Buchsuche).
- ↑ Endométriose: Emmanuel Macron annonce une stratégie nationale de lutte contre la maladie. In: francetvinfo.fr. 12. Januar 2022, abgerufen am 19. Februar 2022 (französisch).
- ↑ Premier comité de pilotage de la Stratégie nationale contre l’endométriose. In: gouvernement.fr. 15. Februar 2022, abgerufen am 19. Februar 2022 (französisch).
- ↑ Semiha Ünlü: „Kampf gegen rätselhafte Frauenkrankheit“, Rheinische Post, Ausgabe Nr. 238 vom 12. Oktober 2024, Sektion C, Seite 2
- ↑ S. Simoens, L. Hummelshoj, T. D’Hooghe: Endometriosis: cost estimates and methodological perspective. In: Hum Reprod Update. 13, 2007, S. 395–404. PMID 17584822, doi:10.1093/humupd/dmm010
- ↑ Kelechi E. Nnoaham, Sivahami Sivananthan, Lone Hummelshoj, Crispin Jenkinson, Premila Webster, Stephen H. Kennedy, Krina T. Zondervan: Endometriosis has a significant effect on women’s work productivity, first worldwide study finds (Ergebnisse der Global Study of Women’s Health (GSWH). vorgetragen auf dem 26. Annual Meeting der European Society of Human Reproduction and Embryology; Rom, Italien, 28. Juni 2010, Abstract ( vom 2. Juli 2010 im Internet Archive), Pressemitteilung der World Endometriosis Research Foundation)
- ↑ Sophie FIchtner: Bis Karl Lauterbach sie hört. In: taz.de. 5. Februar 2022, abgerufen am 10. Februar 2022.
- ↑ World Endometriosis Society Mission
- ↑ The World Endometriosis Research Foundation ( des vom 16. Juni 2017 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Die Europäische Endometriose Liga ( vom 22. November 2010 im Internet Archive)
- ↑ Stiftung Endometriose Forschung ( vom 24. Mai 2012 im Internet Archive)
- ↑ Endometriose-Vereinigung Deutschland e. V.
- ↑ Verein - Endometriose Vereinigung Deutschland e. V. Abgerufen am 27. Juli 2022.
- ↑ Mitteilung ( vom 28. März 2010 im Internet Archive) auf endometriosis.org
- ↑ BZgA Infodienst: Nationale + internationale Gesundheitstage. Abgerufen am 27. Juli 2022.