VSEPR-Modell
Das VSEPR-Modell (Abkürzung für englisch valence shell electron pair repulsion, deutsch Valenzschalen-Elektronenpaar-Abstoßung), auch EPA-Modell (Elektronenpaarabstoßungs-Modell) oder ursprünglich VEPR-Theorie (englisch valence electron pair repulsion theory), führt die räumliche Gestalt eines Moleküls auf die abstoßenden Kräfte zwischen den Elektronenpaaren der Valenzschale zurück.

für zwei und drei Elektronenpaare

Das Modell wird nach seinen Entwicklern auch Gillespie-Nyholm-Theorie genannt.
Die abgeleiteten Regeln
[Bearbeiten | Quelltext bearbeiten]Aus dem VSEPR-Modell ergeben sich folgende Regeln für Moleküle des Typs AXn:[1]
- Die Elektronenpaare der Valenzschale des Zentralatoms (A), d. h. des Atoms im Zentrum des Moleküls, ordnen sich so an, dass der Abstand zwischen ihnen möglichst groß wird.
- Die freien Elektronenpaare (hier mit E symbolisiert) in einem Molekül vom Typ AXnEm beanspruchen mehr Raum als die bindenden Elektronenpaare und führen somit zu einer Vergrößerung der Winkel X-A-E und einer Verkleinerung der Winkel X-A-X.
- Einzelne freie Elektronen in Radikalen nehmen weniger Raum ein als freie Elektronenpaare.
- Größere Elektronegativitätsdifferenzen zwischen A und X vermindern damit den Raumbedarf der entsprechenden Bindung.
- Mehrfachbindungen beanspruchen mehr Raum als Einfachbindungen, wobei der Platzbedarf mit der Bindungsordnung steigt.
- Für die Bestimmung der groben Molekülstruktur werden jedoch nur die Sigma-Bindungen herangezogen, d. h., Mehrfachbindungen werden hier wie Einfachbindungen behandelt.
- Kleinere Zentralatome bzw. größere negativ polarisierte Liganden bewirken eine starke sterische und elektronische Abstoßungskraft, die die eines freien Elektronenpaars übertreffen kann.
Vorhersagen bei freien Elektronenpaaren am Zentralatom
[Bearbeiten | Quelltext bearbeiten]Wenn keine freien Elektronenpaare am Zentralatom vorhanden sind, können Molekülstrukturen recht einfach durch Abzählen der „Reste“ vorhergesagt werden.
Dennoch lässt sich auch die Betrachtung von Verbindungen mit einem oder mehreren stereochemisch aktiven, freien Elektronenpaaren näherungsweise schematisieren. Dazu werden diese – ähnlich wie Bindungspartner – als Pseudoliganden behandelt und mit dem griechischen Buchstaben „ψ“ (Psi) gekennzeichnet. So gelangt man zur Pseudostruktur des jeweiligen Moleküls.
Beispiel: Das Sauerstoffatom des Wassermoleküls, an welches zwei Wasserstoffatome kovalent gebunden sind (X = 2), weist zwei freie Elektronenpaare auf (E = 2). Daraus ergibt sich eine Anzahl von # = 2 + 2 = 4 Pseudoliganden und somit eine tetraedrische Pseudostruktur (Strukturtyp), die als ψ2-Tetraeder beschrieben werden kann. Indem nun die freien Elektronenpaare „weggedacht“ werden, bleibt die in diesem Fall gewinkelte Realstruktur (Molekülstruktur) zurück, die nur durch die Atomkerne beschrieben wird.
Ein Beispiel für ein ψ1-Tetraeder, d. h. mit nur einem freien Elektronenpaar, ist das Ammoniak-Molekül NH3.
| # | Molekültypen a | Beispiel | Ψ – Struktur / Pseudostruktur b | Realstruktur c | Winkel d |
|---|---|---|---|---|---|
| 1 | AX1 |
H2 | linear |
linear |
|
| 2 | AX2 |
BeCl2 CO2 |
linear |
linear |
180° |
AX1E1 |
CO | linear |
linear |
||
| 3 | AX3 |
BF3 NO3− CO32− |
trigonal planar |
 trigonal planar |
120° |
 AX2E |
SO2 O3 NO2− |
 trigonal planar |
gewinkelt |
ca. 115° | |
AX1E2 |
trigonal planar |
linear |
|||
| 4 |  AX4 |
CH4 SO42− PO43− ClO4− |
 tetraedrisch |
 tetraedrisch |
109,5° |
 AX3E |
NH3 PCl3 |
 tetraedrisch |
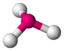 trigonal-pyramidal |
ca. 107° | |
 AX2E2 |
H2O |  tetraedrisch |
gewinkelt |
ca. 104° | |
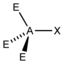 AX1E3 |
HCl |  tetraedrisch |
linear |
||
| 5 |  AX5 |
PCl5 | 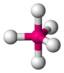 trigonal-bipyramidal |
 trigonal-bipyramidal |
120° / 90° |
 AX4E |
SF4, SCl4 |  trigonal-bipyramidal |
"Wippe", bisphenoidal |
ca. 175° / 110° | |
 AX3E2 |
ClF3 |  trigonal-bipyramidal |
T-förmig |
ca. 87,5° | |
 AX2E3 |
XeF2 | trigonal-bipyramidal |
linear |
180° | |
| 6 |  AX6 |
SF6 |  oktaedrisch (=quadratisch-bipyramidal, trigonal-antiprismatisch) |
 oktaedrisch (=quadratisch-bipyramidal, trigonal-antiprismatisch) |
90° |
 AX5E |
ClF5 |  oktaedrisch (=quadratisch-bipyramidal, trigonal-antiprismatisch) |
 quadratisch-pyramidal |
ca. 85° | |
 AX4E2 |
XeF4 |  oktaedrisch (=quadratisch-bipyramidal, trigonal-antiprismatisch) |
quadratisch-planar |
90° | |
| 7 |  AX7 |
IF7 |  pentagonal-bipyramidal |
 pentagonal-bipyramidal |
90° / 72° |
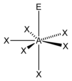 AX6E |
[XeOF5]− |  pentagonal-bipyramidal |
pentagonal-pyramidal |
ca. 90° / ca. 72° | |
 AX5E2 |
XeF5− | pentagonal-bipyramidal |
pentagonal-planar |
72° | |
| 8 | AX8 | IF8− | 
|

tetragonal-antiprismatisch |
78° / 73° |
Anmerkungen:
Grenzen der Anwendbarkeit
[Bearbeiten | Quelltext bearbeiten]Das VSEPR-Modell lässt sich auf Moleküle anwenden, bei denen die an das Zentralatom gebundenen Reste (Atome oder Atomgruppen) nicht allzu groß werden und keine spezifischen Wechselwirkungen aufeinander ausüben.
Nicht oder nur eingeschränkt anwendbar ist sie auf Übergangsmetallverbindungen. Vielfach stimmen jedoch auch bei einfachen Molekülen die Bindungswinkel nicht mit dem Modell überein. Für Verbindungen mit delokalisierten Elektronen kann die Anwendung des Modells ebenfalls mit Schwierigkeiten verbunden sein, hier ist die Hinzuziehung der Molekülorbitaltheorie notwendig.
Literatur
[Bearbeiten | Quelltext bearbeiten]- Reinhart Ahlrichs: Gillespie‐ und Pauling‐Modell — ein Vergleich. In: Chemie in unserer Zeit. Band 14, Nr. 1, 1980, S. 18–24, doi:10.1002/ciuz.19800140104.
- Ronald J. Gillespie, Edward A. Robinson: Models of molecular geometry. In: Chemical Society Reviews. Band 34, Nr. 5, 2005, S. 396–407, doi:10.1039/B405359C.
- R. J. Gillespie, I. Hargittai: The VSEPR Model of Molecular Geometry. 8. Aufl., Allyn & Bacon, Boston 1991, ISBN 978-0-205-12369-8.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 136.