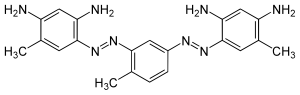
Bismarckbraun Y
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Bismarckbraun Y | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C18H20Cl2N8 (Dihydrochlorid) | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 419,32 g·mol−1 | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Bismarckbraun Y oder Vesuvin ist ein Farbstoff aus der Reihe der kationischen Azofarbstoffe. Benannt wurde der Farbstoff nach Otto von Bismarck, dem Reichsgründer und ersten Kanzler des Deutschen Reichs. Entdeckt wurde es 1863 von Carl Alexander von Martius als der erste Bisazofarbstoff.[2] Die übliche Handelsform ist das Dihydrochlorid.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese von Bismarckbraun Y erfolgt durch Diazotierung und Azokupplung von m-Phenylendiamin in einer Eintopfreaktion.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Bismarckbraun Y hat ein Absorptionsmaximum bei 463 nm in Wasser. Es ist zu 1–5 % (g/v) in Wasser, 1–3 % (g/v) in Ethanol und zu 7 % (g/v) in Ethylenglycol löslich. Sein pKs-Wert liegt bei 5.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Bismarckbraun findet in der Leder-, Papier- und Holzfärberei sowie zur Synthese von Polyazofarbstoffen Verwendung. Darüber hinaus wird es in der Botanik zur Anfärbung von pflanzlichen Zellwänden und in der Mikrobiologie zum Färben von Bakterien in einer modifizierten Gram-Färbung eingesetzt. Robert Koch konnte mit Bismarckbraun die Tuberkelbazillen nachweisen.[3]
Ähnliche Farbstoffe
[Bearbeiten | Quelltext bearbeiten]- Bismarckbraun R (C.I. Basic Brown 4)[4] erhält man durch eine Azokupplung unter Verwendung von 2,4-Diaminotoluol als Diazo- und Kupplungskomponente. Es hat eine rötere Farbnuancierung im Vergleich zu Bismarckbraun Y, hat aber sonst gleiche Färbeeigenschaften. Es wurde auch bei Acrylamidgelen verwendet, um die Anfärbung von Proteinen zu optimieren.
- Bismarckbraun G ist ein Farbstoffgemisch, das neben Bismarckbraun Y einen Monoazofarbstoff enthält, der entsteht, wenn einfach diazotiertes m-Phenylendiamin auf sich selbst kuppelt.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Datenblatt Bismarckbraun Y bei Sigma-Aldrich, abgerufen am 13. März 2011 (PDF).
- ↑ W. Müller (Hrsg.): Handbuch der Farbenchemie. Grundlagen, Technik, Anwendungen. Ecomed Verlagsgesellschaft; 3. Ergänzungslieferung 2003; ISBN 3-609-72700-4; S. 2.
- ↑ Wilhelm Strube: Der historische Weg der Chemie, Aulis-Verlag, Köln 1989, S. 276.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu C.I. Basic Brown 4: CAS-Nr.: 8005-78-5, EG-Nr.: 232-341-8, ECHA-InfoCard: 100.029.399, PubChem: 135516985, ChemSpider: 26501926, Wikidata: Q72444823.
- ↑ W. Müller (Hrsg.): Handbuch der Farbenchemie. Grundlagen, Technik, Anwendungen. Ecomed Verlagsgesellschaft; 3. Ergänzungslieferung 2003; ISBN 3-609-72700-4; S. 24 (Kapitel 4.7).
Literatur
[Bearbeiten | Quelltext bearbeiten]- P. Karrer: Lehrbuch der organischen Chemie. 10. Auflage. Thieme, Stuttgart 1948, S. 514.
- N. Welsch, C. C. Liebmann: Farben – Natur, Technik, Kunst. Spektrum, Heidelberg u. Berlin 2003, S. 204.
- Richard W. Horobin, J. A. Kiernan und John A. Kiernan: Conn’s Biological Stains: A Handbook of Dyes, Stains and Fluorochromes for Use in Biology and Medicine. Garland Pub, 10. Auflage 2002; ISBN 1-85996-099-5; S. 139–140.