1,3-Butadien
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 1,3-Butadien | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C4H6 | |||||||||||||||
| Kurzbeschreibung |
farbloses, unter Druck verflüssigtes Gas mit leicht aromatischem Geruch[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 54,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
gasförmig | |||||||||||||||
| Dichte |
2,4982 kg·m−3 (0 °C)[2] | |||||||||||||||
| Schmelzpunkt |
−108,9 °C[2] | |||||||||||||||
| Siedepunkt |
−4,5 °C[2] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
geringfügig löslich in Wasser (454,1 ml·l−1 bei 20 °C)[2] | |||||||||||||||
| Brechungsindex |
1,4292 (−25 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK |
| |||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
110,0 kJ/mol[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
1,3-Butadien [] (Vinylethylen) ist ein farbloses Gas mit mildem, aromatischem Geruch. Es ist ein ungesättigter Kohlenwasserstoff von großer industrieller Bedeutung. Daneben existiert noch das schwieriger herzustellende und industriell weit weniger bedeutende 1,2-Butadien.
2-Methyl-1,3-butadien oder Isopren, die Grundeinheit der Terpene, ist ein Derivat des Butadiens.
Herstellung
[Bearbeiten | Quelltext bearbeiten]Technische Herstellung
[Bearbeiten | Quelltext bearbeiten]Heutzutage erfolgt die technische Herstellung von 1,3-Butadien weitestgehend durch Isolierung aus der C4-Fraktion, welche beim Steamcracking von Naphtha oder Gasölen erhalten wird. In Europa und Japan wird bevorzugt Naphtha als Rohstoff für den Steamcracker eingesetzt, wodurch der Anteil des C4-Schnitts vergleichsweise hoch ist. Durch das Vorherrschen von Ethancracker zur Herstellung von Ethen ist, vor allem in den USA und Kanada, der Anteil der C4-Fraktion relativ gering, wodurch zusätzliche Dehydrierverfahren der n-Butene und n-Butan entwickelt worden sind.[7][8]
Die C4-Fraktion, welche beim Steamcracken von Naphtha anfällt, besteht aus bis zu zwölf C4-Komponenten, darunter n-Butan, Isobutan, 1-Buten, die 2-Butene, Isobuten, 1,2- und 1,3-Butadien sowie Butenin. Aufgrund der nahe beieinanderliegenden Siedepunkte und des Auftretens von Azeotropen ist eine einfache Destillation bzw. Rektifikation nicht mehr durchführbar. Aus diesem Grund wird zur Isolierung von 1,3-Butadien die Flüssig-Flüssig-Extraktion oder die Extraktivrektifikation angewandt, wobei der Extraktivrektifikation die bei weitem größere Bedeutung zukommt. Letzteres Verfahren ermöglicht die Aufarbeitung der C4-Fraktion in Gegenwart der Acetylene (Ethine) und liefern 1,3-Butadien in hoher Reinheit. Bei der Extraktivrektifikation müssen selektive Lösungsmittel eingesetzt werden, die in der Lage sind, die relative Flüchtigkeit von 1,3-Butadien im Vergleich zu den anderen Komponenten im C4-Schnitt stark herabzusetzen. Da stark ungesättigte Kohlenwasserstoffe zum einen besser in polaren Lösungsmitteln löslich sind und zum anderen ein polares Lösungsmittel die Flüchtigkeit des Kohlenwasserstoffes besser herabsetzen kann als ein nicht-polares Lösungsmittel, werden heutzutage verschiedene polare Lösungsmittel in der Extraktivrektifikation eingesetzt. In den ersten Anlagen, welche während des Zweiten Weltkrieges von Phillips Petroleum in den USA gebaut wurden, wurde Furfural als Lösungsmittel eingesetzt. Das in den 1950er Jahren von Shell entwickelte zweistufige Verfahren nutzt Acetonitril, das Verfahren der Union Carbide hingegen verwendet Dimethylacetamid als Lösungsmittel. In modernen Anlagen nutzen heute das BASF-Verfahren mit N-Methyl-2-pyrrolidon oder das Nippon Zeon Verfahren mit Dimethylformamid als Zusatzstoff.[9]
Als Beispiel für die Extraktivrektifikation von 1,3-Butadien soll hier das BASF-Verfahren beschrieben werden. Als Lösungsmittel wird N-Methyl-2-pyrrolidon (NMP) mit einem Gehalt von 5–10 Gew.-% an Wasser zur Selektivitätssteigerung eingesetzt. Die C4-Fraktion wird zunächst in den unteren Teil des Waschturms (1) geleitet, im oberen Teil der Kolonne wird NMP über Sprühdüsen zugeführt und dabei die stark ungesättigten Verbindungen wie Diene und Acetylene aus der Fraktion herausgelöst. Die Butane und Butene fallen als Kopfprodukt an. Das Sumpfprodukt, bestehend aus 1,2- und 1,3-Butadien, C4-Acetylene und Propin, wird anschließend in zwei Extrakivrektifikationskolonnen (2, 3) geleitet. In der zweiten Kolonne wird zusätzlich NMP in Nähe des Kolonnenkopfes aufgegeben. Die C4-Acetylene und teilweise 1,2-Butadien werden als Sumpfprodukt erhalten, da sie besser in NMP als in 1,3-Butadien löslich sind. Rohes 1,3-Butadien, welches nur noch geringe Mengen an 1,2-Butadien, Propin und C5-Kohlenwasserstoffe enthält, wird am Kopf der Kolonne (3) abgetrennt und einer ersten Rektifikationskolonne zugeführt (8), in der Propin als Kopfprodukt von den restlichen Bestandteilen abgetrennt wird. Im Sumpf der Kolonne wird hauptsächlich ein Gemisch aus 1,3-Butadien mit geringen Mengen an 1,2-Butadien und C5-Kohlenwasserstoffen erhalten, welches in einer nachfolgenden Kolonne (9) weiter aufgetrennt wird. Als Kopfprodukt wird dabei 1,3-Butadien in einer Reinheit von mindestens 99,6 % erhalten, als Sumpfprodukt fällt 1,2-Butadien und die C5-Kohlenwasserstoffe an. Das beladene Lösungsmittel wird vom Sumpf der ersten Extrativrektifikationskolonne in einen Ausgaser (5) geleitet und dort vollständig entgast. Als Sumpfprodukt wird das Lösungsmittel erhalten, welches wieder in den Prozess zurückgeführt wird. Die C4-Acetylene werden als Seitenstrom abgezogen und nach einer Wasserwäsche (6) in einem Hydrierreaktor (7) selektiv hydriert. Unter anderem wird das Butenin praktisch quantitativ zu 1,3-Butadien hydriert und wieder zum Waschturm geführt. Die restlichen Gase aus dem Ausgaser werden nach Verdichtung wieder in die erste Kolonne zur Extraktivrektifikation geleitet.

In einer Weiterentwicklung dieses Verfahrens werden die C4-Acetylene noch vor der Extraktivrektifikation selektiv zu 1,3-Butadien hydriert. Dazu wird das BASF-Verfahren mit dem Honeywell UOP-KLP-Prozess verbunden. Der rohe C4-Schnitt wird mit einer stöchiometrischen Menge an Wasserstoff vermischt und in einem Festbettreaktor über einem selektiven Hydrierkatalysator bei einer Temperatur um 85 °C umgesetzt. Der Druck wird so gewählt, dass die Reaktionsmischung in der Flüssigphase verbleibt und nicht verdampft. Aufgrund von Kohlenstoffablagerungen, die durch Polymerisation verursacht werden, muss der Katalysator all zwei Monate durch Abbrennen mit Sauerstoff regeneriert werden. Dennoch erhöht sich die Ausbeute an 1,3-Butadien im Vergleich zu dem herkömmlichen Zweistufenprozess von 95,5 % auf 99,5 %.[8][9]
Im Jahr 2018 betrug die weltweite Produktionskapazität für 1,3-Butadien etwa 16 Millionen Tonnen, bis Ende 2023 wird eine Steigerung auf etwa 20 Millionen Tonnen prognostiziert.[7]
Laborsynthese
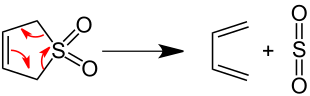
[Bearbeiten | Quelltext bearbeiten]Im Labor wird der Zerfall von 3-Sulfolen in siedendem Xylol in einer [4+1]-Cycloeliminierung zu 1,3-Butadien und Schwefeldioxid verwendet.[10]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Geruchsschwelle von Butadien liegt bei 4 mg/m³. Das Gas lässt sich leicht verflüssigen. Butadien ist schwerer als Luft und in Wasser – mit 1,03 g/l bei 20 °C – nur sehr gering löslich.
Butadien ist brennbar und polymerisiert leicht, weswegen ihm meist ein Stabilisator wie das 4-tert-Butylbrenzcatechin (TBC) beigefügt wird. Die Polymerisationswärme beträgt −73 kJ·mol−1 bzw. −1350 kJ·kg−1.[11]
Konjugierte Doppelbindungen beim 1,3-Butadien
[Bearbeiten | Quelltext bearbeiten]| Konjugierte π-Bindung |
 Delokalisiertes Molekülorbital bei 1,3-Butadien |
Im planar gebauten Molekül sind alle vier Kohlenstoffatome sp2-hybridisiert. Die π-Orbitale überlappen sich ober- und unterhalb der Molekülebene. π-Bindungen entstehen durch Überlappung bei dem 1. und 2. Kohlenstoffatom sowie dem 3. und 4. Kohlenstoffatom. Zusätzlich können aber die Orbitale des 2. und des 3. Kohlenstoffatoms überlappen, so dass sich die π-Elektronen über das ganze Molekül ausbreiten können. Die Elektronen sind delokalisiert. Dadurch, dass sich Elektronen auf einem größeren Raum verteilen, wird im 1,3-Butadien eine erhöhte Stabilität beobachtet. Der Einfluss dieser konjugierten Doppelbindungen zeigt sich bei Additionsreaktionen von Butadien: Es können sich 1,2- und 1,4-Addukte bilden. Im letzten Fall bildet sich zwischen dem 2. und dem 3. Atom eine „neue“ Doppelbindung. Analog verlaufen Polyadditionsreaktionen von Butadien, die zu 1,2-Polybutadien oder 1,4-Polybutadien führen. Das Verhältnis von 1,4- zu 1,2-Verknüpfung hängt stark von der Polymerisationsmethode und den Reaktionsbedingungen ab.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Mehr als 90 Prozent der Produktion von Butadien wird zu Synthesekautschuk weiterverarbeitet. Eine weitere Anwendung ist ABS, ein Terpolymerisat aus Acrylnitril, Butadien und Styrol. Das Copolymer mit Styrol (SBC, Styroflex) wird als Folie z. B. für Kunststoff-Folienkondensatoren verwendet. Außerdem wird aus Butadien und Blausäure in technischem Maßstab Adiponitril hergestellt, das ein Zwischenprodukt in der Produktion von Polyamiden ist. Aus Butadien werden Hydroxyl-terminierte Polybutadiene (HTPB) hergestellt, die als Treibstoff in Feststoffraketentriebwerken eingesetzt werden. Cyclobuten kann durch photochemische Cyclisierung von 1,3-Butadien erhalten werden:[12]

Diese Methode verläuft allerdings nur mit 30 %iger Ausbeute.[13]
Durch Reaktion mit Allylmagnesiumbromid und Diethylether, anschließender Hydrolyse mit Salzsäure und Neutralisation mit Natriumhydrogencarbonat kann ein Gemisch aus 1,6-Heptadien und 1,5-Heptadien[S 1] gewonnen werden.[14]
Historisches
[Bearbeiten | Quelltext bearbeiten]Das aus Butadien und dem Katalysator Natrium produzierte Polymer Buna (ButadienNatrium) hatte große Bedeutung für die deutsche Rüstungs- und Kriegswirtschaft vor und während des Zweiten Weltkrieges.
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Butadien ist hochentzündlich. Zwischen einem Luftvolumenanteil von 1,4 bis 16,3 Prozent bildet es explosive Gemische. Butadien wirkt narkotisierend. Beim Menschen wirkt 1,3-Butadien krebserregend.[15] Bei Industriearbeitern, die über längere Zeit einer Exposition mit 1,3-Butadien ausgesetzt waren, wurde eine erhöhte Anzahl an Krebserkrankungen festgestellt. Dabei handelte es sich vor allem um lympho-hämatopoetische Malignome (maligne Lymphome und Leukämien).[16]
1,3-Butadien wurde 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von 1,3-Butadien waren die Besorgnisse bezüglich der Einstufung als CMR-Stoff. Die Neubewertung fand ab 2014 statt und wurde von Deutschland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[17][18]
Berufskrankheit
[Bearbeiten | Quelltext bearbeiten]Seit August 2017 können bestimmte Erkrankungen durch 1,3-Butadien in Deutschland auf Antrag als Berufskrankheit anerkannt werden (Nummer 1320 der Anlage 1 zur Berufskrankheiten-Verordnung – BKV). Das gilt auch für solche Erkrankungen, die vor diesem Termin eingetreten sind (§ 6 Abs. 1 BKV).
Literatur
[Bearbeiten | Quelltext bearbeiten]- J. Grub, E. Löser: Butadiene. In: Ullmanns Enzyklopädie der Technischen Chemie. Wiley-VCH Verlag, Weinheim 2012; doi:10.1002/14356007.a04_431.pub2.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu BUTADIENE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. Mai 2023.
- ↑ a b c d e f g h i j k Eintrag zu 1,3-Butadien in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Mai 2023. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-72.
- ↑ Eintrag zu Buta-1,3-diene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 106-99-0 bzw. 1,3-Butadien), abgerufen am 21. September 2019.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ a b Manfred Baerns, Arno Behr, Axel Brehm, Jürgen Gmehling, Kai-Olaf Hinrichsen, Hanns Hofmann, Michael Kleiber, Norbert Kockmann, Ulfert Onken, Regina Palkovits, Albert Renken, Dieter Vogt: Technische Chemie. 3. Auflage. Wiley-VCH, Weinheim 2023, ISBN 978-3-527-34574-8, S. 732–733.
- ↑ a b Roland Dittmeyer, Wilhelm Keim, Gerhard Kreysa, Alfred Oberholz (Hrsg.): Winnacker • Küchler: Chemische Technik – Prozesse und Produkte – Energieträger, Organische Grundstoffe. 5. Auflage. Band 4. Wiley-VCH, Weinheim 2005, ISBN 978-3-527-30769-2.
- ↑ a b Joachim Grub, Eckhard Löser: Butadiene. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, 15. Oktober 2011, doi:10.1002/14356007.a04_431.pub2.
- ↑ Siegfried Hauptmann: Reaktion und Mechanismus in der organischen Chemie. B. G. Teubner, Stuttgart 1991, ISBN 3-519-03515-4, S. 131.
- ↑ Berufsgenossenschaft Rohstoffe und chemische Industrie, Merkblatt R 008 Polyreaktionen und polymerisationsfähige Systeme, Ausgabe 05/2015, ISBN 978-3-86825-069-5.
- ↑ Waldemar Adam, Thomas Oppenlaender, Gerald Zang: The 185-nm photochemistry of cyclobutene and bicyclo[1.1.0]butane. In: Journal of the American Chemical Society. 107, 1985, S. 3921–3924, doi:10.1021/ja00299a028.
- ↑ Albert Gossauer: Struktur und Reaktivität der Biomoleküle, Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 978-3-906390-29-1, S. 143.
- ↑ Daniel Bellus, Chao-Jun Li, Teck-Peng Loh, Istvan Marko, Keiji Maruoka, Norikazu Miyoshi, Kunio Mochida, Ryoji Noyori, Masataka Oishi, Takashi Ooi, Susumu Saito, Makoto Shimizu, Tamotsu Takahashi, Sadao Tsuboi, Masahiko Yamaguchi, Hisashi Yamamoto, Akira Yanagisawa, Hajime Yasuda: Science of Synthesis: Houben-Weyl Methods of Molecular Transformations Vol. 7: Compounds of Groups 13 and 2 (Al, Ga, In, Tl, Be...Ba). Georg Thieme Verlag, 2014, ISBN 3-13-171771-8, S. 569 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (Hrsg.): 1,3-Butadiene, ethylene oxide, and vinyl halides (vinyl fluoride, vinyl chloride, and vinyl bromide) (= IARC monographs on the evaluation of carcinogenic risks to humans. Band 97). International Agency for Research on Cancer, Lyon/Geneva 2008, ISBN 978-92-832-1297-3 (iarc.fr).
- ↑ 1,3-BUTADIENE – Risk Assessment Report. (PDF; 4,5 MB) European Commission, Joint Research Centre, Institute for Health and Consumer Protection, European Chemicals Bureau, 2002.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Report und Conclusion Document.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): Buta-1,3-diene, abgerufen am 26. März 2019.
Weblinks
[Bearbeiten | Quelltext bearbeiten]Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,5-Heptadien: CAS-Nr.: 1541-23-7, ECHA-InfoCard: 100.204.864, PubChem: 5364394, ChemSpider: 4516550, Wikidata: Q131384965.


