3-Sulfolen
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 3-Sulfolen | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H6O2S | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 118,15 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt |
| |||||||||||||||
| Löslichkeit |
kaum löslich in Wasser (130 g/l (bei 20 °C)[3], löslich in Ethanol, Benzol, Diethylether[1] und Chloroform[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
3-Sulfolen ist ein einfach ungesättigtes cyclisches Sulfon, das aus 1,3-Butadien und Schwefeldioxid (SO2) in einer (4+1)-cheletropen Reaktion[6] gebildet wird und bei Temperaturen oberhalb 80 °C in einer (4+1)-Cycloeliminierung in die gasförmigen Ausgangsstoffe zerfällt. Daher dient es als einfach handhabbare „feste“ Form von cis-1,3-Butadien und SO2[7] und findet als Dien in Diels-Alder-Reaktionen breitere Verwendung.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Zur Herstellung von 3-Sulfolen wird in einem Autoklaven bei ca. −20 °C flüssiges 1,3-Butadien zusammen mit einem Überschuss von flüssigem Schwefeldioxid in Gegenwart von geringen Mengen eines phenolischen Polymerisationsinhibitors, wie z. B. Hydrochinon oder Pyrogallol, kondensiert und bei Raumtemperatur acht Tage stehen gelassen[8] bzw. 30 Minuten auf ca. 130 °C erhitzt.[9]

Nach Umkristallisieren aus Ethanol wird das Reinprodukt in fast quantitativer Ausbeute erhalten.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]3-Sulfolen ist ein weißer, geruchloser, kristalliner, unbegrenzt stabiler Feststoff, der sich in Wasser und vielen organischen Lösungsmitteln löst.[7] Der gelegentlich berichtete stechende Geruch[3] rührt wahrscheinlich von anhaftendem Schwefeldioxid her. Die Verbindung löst sich unverändert in konzentrierten Säuren, wie z. B. Salpetersäure oder Schwefelsäure, und kann sogar aus konzentrierter HNO3 umkristallisiert werden.[8]
Die Wasserstoffatome in 2- und 5-Stellung des 3-Sulfolens lassen sich rasch und vollständig im Alkalischen[10] oder unter Katalyse mit Natriumcyanid[11] durch Deuteriumatome (aus Deuteriumoxid) austauschen.

3-Sulfolen isomerisiert im Alkalischen oder unter Katalyse mit Cyanidionen zu einem Gemisch von 2-Sulfolen und 3-Sulfolen, dessen Zusammensetzung vom Verhältnis Cyanid/Sulfolen abhängt.[11]
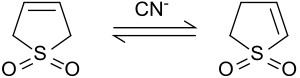
Bei 50 °C stellt sich ein Gleichgewicht zwischen 42 % 3-Sulfolen und 58 % 2-Sulfolen ein.[12] Aus dem Isomerengemisch kann durch mehrtägiges Erhitzen auf 100 °C das thermodynamisch stabilere 2-Sulfolen wegen der thermischen Zersetzung des 3-Sulfolens bei Temperaturen oberhalb von 80 °C als Reinsubstanz in Form weißer Platten (Smp. 48–49 °C) isoliert werden.[13]
Bei höheren Temperaturen, besonders oberhalb ca. 110 °C[7], zerfällt 3-Sulfolen in einer retro-cheletropen Reaktion zu reinem cis-1,3-Butadien und Schwefeldioxid.[8][14]
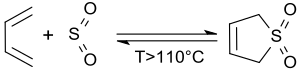
Bei der in situ-Erzeugung und sofortigen Umsetzung von cis-1,3-Butadien wird der Kontakt mit dem Dien (entzündlich, krebserregend, mit Luft explosive Gemische bildend) weitgehend vermieden.
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Reaktionen an 3-Sulfolen
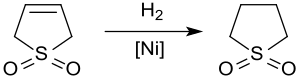
[Bearbeiten | Quelltext bearbeiten]Die Hydrierung von 3-Sulfolen an Raney-Nickel bei ca. 20 bar und 60 °C liefert wegen der Vergiftung des Katalysators durch Schwefelverbindungen Sulfolan lediglich in Ausbeuten bis 65 %.[15]
3-Sulfolen addiert in wässriger Lösung Brom leicht zum 3,4-Dibrom-tetrahydrothiophen-1,1-dioxid, das sich von H. Staudinger[8] mit Silbercarbonat nicht zum Thiophen-1,1-dioxid dehydrobromieren ließ. Über den Umweg der Bildung des 3,4-Bis(dimethylamino)tetrahydrothiophen-1,1-dioxid und aufeinanderfolgende zweifache Quaternisierung mit Methyliodid und Hofmann-Eliminierung mit Silberhydroxid ist das reaktive und nur in Lösung stabile Thiophen-1,1-dioxid zugänglich.[13]
Weniger umständlich ist die zweistufige Synthese mit zweifacher Dehydrobromierung von 3,4-Dibrom-tetrahydrothiophen-1,1-dioxid mit gepulvertem Natriumhydroxid in Tetrahydrofuran (THF)[16] oder mit per Ultraschall dispergiertem metallischem Kalium.[17]

Die Lösung von Thiophen-1,1-dioxid in THF kann direkt in einer [4+6]-Cycloaddition mit 6-Dimethylaminofulven[18] zur Synthese des blauen aromatischen Kohlenwasserstoffs Azulen eingesetzt werden.[16]

Die Reinausbeute an Azulen beträgt 33 %.[19]
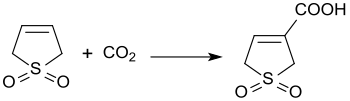
Die Reaktion von 3-Sulfolen mit Kohlendioxid bei 3 bar Druck und in Gegenwart von Diazabicycloundecen erzeugt 3-Sulfolen-3-carbonsäure in 45%iger Ausbeute.[20]
Mit Diazomethan bildet 3-Sulfolen in einer 1,3-dipolaren Cycloaddition in 90%iger Ausbeute unter Ringschluss ein anelliertes Fünfringsystem.[6]

Diels-Alder-Reaktionen mit 3-Sulfolen
[Bearbeiten | Quelltext bearbeiten]Bereits 1938 berichteten Kurt Alder und Mitarbeiter über Diels-Alder-Addukte aus dem isomeren 2-Sulfolen mit 1,3-Butadien und 2-Sulfolen mit Cyclopentadien.[21]

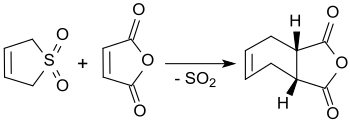
Mit Maleinsäureanhydrid reagiert 3-Sulfolen in siedendem Xylol in Ausbeuten bis 90 % zu cis-4-Cyclohexen-1,2-dicarbonsäureanhydrid.[22]
Auch mit Dienophilen in trans-Konfiguration, wie z. B. Diethylfumarat reagiert 3-Sulfolen bei 110 °C unter SO2-Abspaltung in 66- bis 73%iger Ausbeute zum trans-4-Cyclohexen-1,2-dicarbonsäurediethylester.[23]

Das nach Debromierung aus 1,2,4,5-Tetrabrombenzol mittels eines Äquivalents n-Butyllithium und Diels-Alder-Reaktion mit Furan in 70%iger Ausbeute[24] zugängliche 6,7-Dibrom-1,4-epoxy-1,4-dihydronaphthalin (6,7-Dibromnaphthalin-1,4-endoxid) reagiert mit 3-Sulfolen in siedendem Xylol ein tricyclisches Addukt, das durch Behandlung mit Perchlorsäure ein Dibromdihydroanthracen ergibt, das in der letzten Stufe mit 2,3-Dichlor-5,6-dicyano-1,4-benzochinon (DDQ) zum 2,3-Dibromanthracen dehydriert wird.[25]

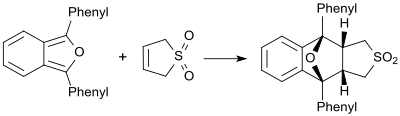
Gegenüber sehr reaktiven Dienen, wie z. B. 1,3-Diphenylisobenzofuran, verhält sich Butadiensulfon als Dienophil und bildet das entsprechende Diels-Alder-Addukt.[26]
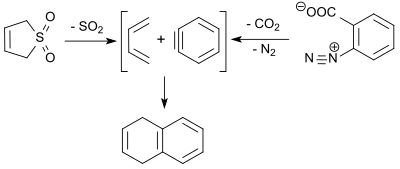
Das bei der retro-cheletropen Reaktion von 3-Sulfolen entstehende 1,3-Butadien reagiert mit dem durch thermische Zersetzung von Benzoldiazonium-2-carboxylat erhaltenen Dienophil Dehydrobenzol (engl. benzyne) in 2-Pentanon bei 100 °C in 9%iger Ausbeute zu 1,4-Dihydronaphthalin.[27]
Polymerisation von 3-Sulfolen
[Bearbeiten | Quelltext bearbeiten]In ihren Arbeiten aus dem Jahr 1935 fanden H. Staudinger und Mitarbeiter, dass sich bei der Reaktion von Butadien und SO2 bei Raumtemperatur neben kristallinem Butadiensulfon (89 % Ausbeute) in geringen Mengen ein amorphes festes Polymer bildet. Durch radikalische Polymerisation von Butadiensulfon in peroxidhaltigem Diethylether erhielten sie bis zu 50 % unlösliche hochmolekulare Poylbutadiensulfone[14], die auch in konzentrierter Salpeter- und Schwefelsäure stabil waren.
In späteren Untersuchungen konnte 3-Sulfolen bei Temperaturen unterhalb 80 °C weder ionisch noch radikalisch, jedoch oberhalb 100 °C und mit dem Radikalinitiator Azobis(isobutyronitril) (AIBN) zu Polybutadiensulfon polymerisiert werden.[28] Mit Vinylverbindungen copolymerisiert 3-Sulfolen hingegen nicht. Dagegen homopolymerisiert 2-Sulfolen nicht, bildet aber mit Vinylverbindungen, wie z. B. Acrylnitril und Vinylacetat Copolymere.
3-Sulfolen als recyclierbares Lösungsmittel
[Bearbeiten | Quelltext bearbeiten]Die Reversibilität der Bildung von 3-Sulfolen und seines Zerfalls in die Ausgangsstoffe 1,3-Butadien und Schwefeldioxid legen die Vermutung nahe, dass Butadiensulfon als recyclierbares aprotisch-dipolares Lösungsmittel Verwendung finden und das ähnliche, häufig eingesetzte, aber schwierig abzutrennende und schlecht wiederverwendbare Dimethylsulfoxid (DMSO) zu ersetzen.[29] Als Modellreaktion wurde die Umsetzung von Benzylhalogeniden, wie z. B. Benzylchlorid oder Benzylbromid mit Natriumazid zum Benzylazid und dessen Reaktion mit 4-Toluolsulfonsäurecyanid zum 1-Benzyl-5-(4-toluolsulfonyl)tetrazol herangezogen.

Die Synthese lässt sich auch als Eintopfreaktion ohne Isolierung des Benzylazids mit 72%iger Gesamtausbeute durchführen. Nach Reaktionsende wird das Lösungsmittel Butadiensulfon bei 135 °C gespalten und das flüchtige Butadien (Smp. −4,5 °C) und Schwefeldioxid (Smp. −10,05 °C) in einer mit überschüssigem Schwefeldioxid beschickten Kühlfalle bei −76 °C flüssig abgeschieden. Beim Erwärmen auf Raumtemperatur – nach Zusatz von Hydrochinon zur Polymerisationsinhibierung – wird wieder praktisch quantitativ 3-Sulfolen gebildet.
Es erscheint fraglich, ob 3-Sulfolen mit einem nutzbaren Flüssigphasenbereich von 64 bis maximal ca. 100 °C als DMSO-Ersatz die aus den 20-Milliliter-Ansätzen postulierten „deutlichen“ Vorteile (einfache Handhabung, niedrige Kosten, Umweltverträglichkeit) in der industriellen Praxis unter Beweis stellen kann.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Datenblatt 3-Sulfolene, 98% bei Alfa Aesar, abgerufen am 5. Juli 2017 (Seite nicht mehr abrufbar).
- ↑ Datenblatt 3-Sulfolen bei Sigma-Aldrich, abgerufen am 5. Juli 2017 (PDF).
- ↑ a b c d Datenblatt 3-Sulfolen zur Synthese bei Merck, abgerufen am 5. Juli 2017.
- ↑ William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–188.
- ↑ a b Eintrag zu 3-Sulfolen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- ↑ a b M.E. Brant, J.E. Wulff: 3-Sulfolenes and their derivatives: Synthesis and applications. In: Synthesis. Band 48, Nr. 01, 2016, S. 1–17, doi:10.1055/s-0035-1560351.
- ↑ a b c J.M. McIntosh: 3-Sulfolene. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. 2001, doi:10.1002/047084289X.rs130.
- ↑ a b c d Patent DE506839: Verfahren zur Darstellung von monomolekularen Reaktionsprodukten von ungesättigten Kohlenwasserstoffen der Butadienreihe mit Schwefeldioxyd. Veröffentlicht am 28. August 1930, Anmelder: H. Staudinger, Erfinder: H. Staudinger.
- ↑ Houben-Weyl: Methods of Organic Chemistry, 4th Edition, Volume IX: Sulfur, Selenium, Tellurium Compounds. Georg Thieme Verlag, Stuttgart 1955, ISBN 978-3-13-208104-8, S. 237.
- ↑ J. Leonard, A.B. Hague, J.A. Knight: Organosulfur Chemistry, 4th Edition, Volume 2, 6. Preparation of substituted 3-sulfolenes and their use as precursors for Diels-Alder dienes. Academic Press, Inc., San Diego 1998, ISBN 0-12-543562-2, S. 241.
- ↑ a b Patent US4187231: Cyanide-catalyzed isomerization and deuterium exchange with alpha- and beta-sulfolenes. Angemeldet am 16. November 1977, veröffentlicht am 5. Februar 1980, Anmelder: Phillips Petroleum Co., Erfinder: R.L. Cobb.
- ↑ C.D. Broaddus: Equilibria and base-catalyzed exchange of substituted olefins. In: Acc. Chem. Res. Band 1, Nr. 8, 1968, S. 231–238, doi:10.1021/ar50008a002.
- ↑ a b W.J. Bailey, E.W. Cummins: Cyclic dienes. III. The synthesis of thiophene-1,1-dioxide. In: J. Am. Chem. Soc. Band 76, Nr. 7, 1954, S. 1932–1936, doi:10.1021/ja01636a058.
- ↑ a b H. Staudinger, B. Ritzenthaler: Über hochmolekulare Verbindungen, 104. Mitteil.: Über die Anlagerung von Schwefeldioxyd an Äthylen-Derivate. In: Chem. Ber. Band 68, Nr. 3, 1935, S. 455–471, doi:10.1002/cber.19350680317.
- ↑ Patent US4286099: Sulfolene hydrogenation. Angemeldet am 12. Februar 1980, veröffentlicht am 25. August 1981, Anmelder: Phillips Petroleum Co., Erfinder: M.E. Nash, E.E. Huxley.
- ↑ a b D.M. Lemal, G.D. Goldman: Synthesis of azulene, a blue hydrocarbon. In: J. Chem. Educ. Band 65, Nr. 10, 1988, S. 923, doi:10.1021/ed065p923.
- ↑ T.-S. Chou, M.-M. Chen: Chemoselective reactions of ultrasonically dispersed potassium with some brominated hydrothiophene-S,S-dioxides. In: Heterocycles. Band 26, Nr. 11, 1987, S. 2829–2834, doi:10.3987/R-1987-11-2829.
- ↑ K. Hafner, K.H. Vöpel, G. Ploss, C. König: 6-(Dimethylamino)fulvene In: Organic Syntheses. 47, 1967, S. 52, doi:10.15227/orgsyn.047.0052; Coll. Vol. 5, 1973, S. 431 (PDF).
- ↑ D. Copland, D. Leaver, W.B. Menzies: A new and convenient synthesis of azulenes from 6-N,N-dimethylaminofulvene and thiophene-1,1-dioxides. In: Tetrahedron Lett. Band 18, Nr. 7, 1977, S. 639–640, doi:10.1016/S0040-4039(01)92713-3.
- ↑ G.S. Andrade et al.: The one-pot synthesis and Diels-Alder reactivity of 2,5-dihydrothiophene-1,1-dioxide-3carboxylic acid. In: Synth. Commun. Band 33, Nr. 20, 2003, S. 3643–3650, doi:10.1081/SCC-120024845.
- ↑ K. Alder, H.F. Rickert, E. Windemuth: Zur Kenntnis der Dien-Synthese, X. Mitteil.: Über die Dien-Synthese mit α, β-ungesättigten Nitrokörpern, Sulfonen und Thio-Äthern. In: Chem. Ber. Band 71, Nr. 12, 1938, S. 2451–2461, doi:10.1002/cber.19380711206.
- ↑ T.E. Sample, Jr., L.F. Hatch: 3-Sulfolene: a butadiene source for a Diels-Alder synthesis: an undergraduate laboratory experiment. In: J. Chem. Educ. Band 45, Nr. 1, 1968, S. 55, doi:10.1021/ed045p55.
- ↑ T.E. Sample, Jr., L.F. Hatch: Diethyl trans-Δ4-tetrahydrophthalate In: Organic Syntheses. 50, 1970, S. 43, doi:10.15227/orgsyn.050.0043; Coll. Vol. 6, 1988, S. 454 (PDF).
- ↑ H. Hart, A. Bashir-Hashemi, J. Luo, M.A. Meador: Iptycenes: Extended triptycenes. In: Tetrahedron. Band 42, Nr. 6, 1986, S. 1641–1654, doi:10.1016/S0040-4020(01)87581-5.
- ↑ C.-T. Lin, T.-C. Chou: Synthesis of 2,3-dibromoanthracene. In: Synthesis. Band 1988, Nr. 8, 1988, S. 628–630, doi:10.1055/s-1988-27659.
- ↑ M.P. Cava, J.P. VanMeter: Condensed cyclobutane aromatic compounds. XXX. Synthesis of some unusual 2,3-naphthoquinonoid heterocycles. A synthetic route to derivatives of naphtho[2,3-b]biphenylene and anthra[b]cyclobutene. In: J. Org. Chem. Band 34, Nr. 3, 1969, S. 538–545, doi:10.1021/jo01255a012.
- ↑ L.F. Hatch, D. Peter: Reaction of benzyne with butadiene. In: Chem. Commun. (London). Band 23, 1968, S. 1499, doi:10.1039/C19680001499.
- ↑ E.J. Goethals: On the polymerization and copolymerization of sulfolenes. In: Macromol. Chem. Phys. Band 109, Nr. 1, 1967, S. 132–142, doi:10.1002/macp.1967.021090113.
- ↑ Y. Huang et al.: Butadiene sulfone as 'volatile', recyclable dipolar, aprotic solvent for conducting substitution and cycloaddition reactions. In: Sus. Chem. Proc. Band 3, Nr. 13, 2015, doi:10.1186/s40508-015-0040-7.
