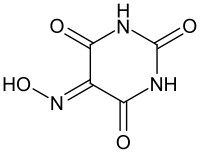
Violursäure
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Violursäure | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H3N3O4 | |||||||||||||||
| Kurzbeschreibung |
gelblicher Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 157,08 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest[2] | |||||||||||||||
| Schmelzpunkt |
240 °C (Zersetzung)[2] | |||||||||||||||
| Löslichkeit | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Violursäure ist eine organische Verbindung. Sie kristallisiert als weißes oder cremefarbenes Monohydrat.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Violursäure wurde von Adolf von Baeyer durch Reaktion von Barbitursäure mit Salpetriger Säure hergestellt.[4] Sie kann auch durch Kondensation von Alloxan mit Hydroxylamin hergestellt werden,[5][6] wie es typisch für die Bildung von Oximen aus anderen Carbonylverbindungen ist.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Violursäure hat die Formel HON=C(CONH)2CO. Sie bildet farblose bis hellgelbe Kristalle, die in Wasser unter Bildung einer violetten Lösung löslich sind.[7]

Die Verbindung deprotoniert leicht und ergibt Salze des Anions [ON=C(CONH)2CO]−, welche oft intensiv farbig sind.[8][5]
Auch die meisten Derivate der Violursäure bilden mit vielen Metallen und Stickstoffbasen intensiv farbige Salze.[9] Mit einer Eisen(III)-chloridlösung gibt die Verbindung eine blaue Färbung.[7]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Violursäure und viele ihrer Derivate, wie Thioviolursäure, 1,3-Dimethylviolursäure[10] und Diphenylthioviolursäure, wurden in der Vergangenheit als analytische Reagenzien für die spekrophotometrische Bestimmung und Titration verschiedener Metalle und Metallionen verwendet.[11] Es wurde auch als Färbe-/Sprühmittel für die anorganische Papierchromatographie verwendet, um Metalle anhand ihrer Farbe zu identifizieren und zu trennen.[12]
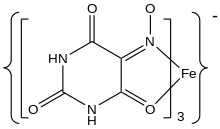
Aufgrund der charakteristischen und vielfältigen Farben, die bei der Salzbildung mit Alkalimetallen entstehen, wurde Violursäure photometrisch zur Bestimmung des Natriumgehalts im Blutserum verwendet.[14]
Violursäure wird auch zur photometrischen Bestimmung von Cobalt sowie zum Nachweis chromatographisch getrennter Metall-Kationen wie Kupfer oder Alkalimetalle durch intensiv gefärbte Chelate verwendet.[15]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c David R. Lide: CRC Handbook of Chemistry and Physics. (Special Student Edition). CRC-Press, 1995, ISBN 978-0-8493-0595-5, S. 672 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Santa Cruz Biotechnology: Violuric Acid | CAS 87-39-8 | SCBT - Santa Cruz Biotechnology, abgerufen am 13. Juli 2023
- ↑ a b PubChem: 66599
- ↑ Adolf Baeyer: Untersuchungen über die Harnsäuregruppe. In: Annalen der Chemie und Pharmacie. Band 127, Nr. 2, 1. Januar 1863, S. 199–236, doi:10.1002/jlac.18631270214 (zenodo.org [abgerufen am 13. Juli 2023]).
- ↑ a b Phil Liebing, Franziska Stein, Liane Hilfert, Volker Lorenz, Karyna Oliynyk, Frank T. Edelmann: Synthesis and Structural Investigation of Brightly Colored Organoammonium Violurates. In: Zeitschrift für Anorganische und Allgemeine Chemie. Band 645, 27. November 2018, S. 36–43, doi:10.1002/zaac.201800439 (englisch, semanticscholar.org [abgerufen am 13. Juli 2023]).
- ↑ J. Guinchard: Ueber die farbigen Salze aus Violursäure und anderen ringförmigen Oximidoketonen. In: Berichte der Deutschen Chemischen Gesellschaft. Band 32, Nr. 2, 1899, S. 1723–1741, doi:10.1002/cber.18990320260.
- ↑ a b Violursäure. In: Lexikon der Chemie. Spektrum Akademischer Verlag, abgerufen am 13. Juli 2023.
- ↑ Gary S. Nichol, William Clegg: Ammonium Violurate: A Compact Structure with Extensive Hydrogen Bonding in Three Dimensions. In: Acta Crystallographica Section C Crystal Structure Communications. Band 63, Nr. 10, 29. September 2007, S. o609–o612, doi:10.1107/S0108270107044241, PMID 17917236.
- ↑ Volker Lorenz, Phil Liebing, Felix Engelhardt, Franziska Stein, Marcel Kühling, Lea Schröder, Frank T. Edelmann: Review: the multicolored coordination chemistry of violurate anions. In: Journal of Coordination Chemistry. 72. Jahrgang, Nr. 1, 2. Januar 2019, S. 1–34, doi:10.1080/00958972.2018.1560431 (englisch).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 1,3-Dimethylviolursäure: CAS-Nr.: 5417-13-0, EG-Nr.: 813-694-2, ECHA-InfoCard: 100.245.281, Wikidata: Q82952074.
- ↑ M. E. Taylor, R. J. Robinson: The Use of 1,3-Dimethylvioluric Acid in Spectrophotometric Titrations of Alkali and Alkaline Earth Salts. In: Analytical Chemistry. 34. Jahrgang, Nr. 4, 1. April 1962, S. 533–536, doi:10.1021/ac60184a026 (englisch).
- ↑ A. K. Singh, Mohan Katyal, R. P. Singh: Violuric Acids as Analytical Reagents. In: Current Science. 45. Jahrgang, Nr. 11, 1976, S. 405–408, JSTOR:24079761 (englisch).
- ↑ Colin L. Raston, Allan H. White: Salts of the Tris(violurato)ferrate(II) Ion: Crystal Structure of Ammonium Tris(violurato)ferrate(II) Hydrate. In: Journal of the Chemical Society, Dalton Transactions. Nr. 19, 1976, S. 1915, doi:10.1039/DT9760001915 (englisch).
- ↑ R.F. Muraca: Photometric determination of sodium in blood serum with violuric acid. In: Chemist Analyst. Band 44. J. T. Baker Chemical Company, Juni 1955, S. 38–42 (englisch, eingeschränkte Vorschau in der Google-Buchsuche [abgerufen am 13. Juli 2023]).
- ↑ Eintrag zu Violursäure. In: Römpp Online. Georg Thieme Verlag, abgerufen am 26. Mai 2021.
