Weinlacton
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|

| ||||||||||
| Allgemeines | ||||||||||
| Name | Weinlacton | |||||||||
| Andere Namen |
(3S,3aS,7aR)-3,6-Dimethyl-3a,4,5,7a-tetrahydro-3H-1-benzofuran-2-on | |||||||||
| Summenformel | C10H14O2 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 166,22 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt |
50–51 °C (3S,3aS,7aR)[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Das Weinlacton ist eine im Wein vorkommende chemische Verbindung aus der Gruppe der bicyclischen Lactone. Es besitzt einen intensiv süßen und kokosnussartigen Geruch,[3] der auch in großer Verdünnung noch wahrnehmbar ist.
Isomere
[Bearbeiten | Quelltext bearbeiten]
Aufgrund des strukturellen Aufbaus des Moleküls mit drei Stereozentren gibt es vier Enantiomerenpaare bzw. acht Diastereomere.
Das eigentliche Weinlacton liegt in der (3S,3aS,7aR)-Konfiguration vor und weist die niedrigste Geruchsschwelle von allen Isomeren auf, es ist bereits in einer Konzentration von 0,00001 bis 0,00004 Nanogramm pro Liter Luft wahrnehmbar.
Die sehr unterschiedlichen Geruchsschwellen der acht Isomere in Luft wurden wie folgt bestimmt:
| Strukturformel | Konfiguration nach CIP-Konvention | CAS-Nummer | Geruchsschwelle [ng/l][4] |
|---|---|---|---|
 |
(3S,3aS,7aS) | 182699-81-6 | 0,007–0,014 |
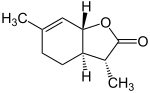 |
(3R,3aR,7aR) | 14–28 | |
 |
(3R,3aR,7aS) | 182699-78-1 | > 1000 (geruchlos) |
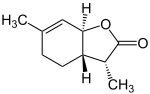 |
(3R,3aS,7aS) | 182699-83-8 | 8–16 |
 |
(3S,3aR,7aR) | 0,05–0,2 | |
 |
(3S,3aS,7aR) | 182699-77-0 | 0,00001–0,00004 |
 |
(3S,3aR,7aS) | 182699-80-5 | 80–160 |
 |
(3R,3aS,7aR) | 182699-79-2 | > 1000 (geruchlos) |
Das Racemat trägt die CAS-Nummer 78168-36-2. Die Isomere lassen sich gaschromatographisch an einer chiralen stationären Phase trennen.[4]
Darstellung
[Bearbeiten | Quelltext bearbeiten](3S,3aS,7aR)-Weinlacton und (3R,3aS,7aR)-Weinlacton lassen sich aus (1R)-trans-Isolimonen darstellen.[5]

Nach einer mehrstufigen Umsetzung wird ein Gemisch aus (3S,3aS,6R,7R,7aR)-7-Iodo-3,6-dimethylhexahydrobenzofuran-2(3H)-on und (3R,3aS,6R,7R,7aR)-7-Iodo-3,6-dimethylhexahydrobenzofuran-2(3H)-on erhalten, welches sich chromatographisch auftrennen lässt. Das gewünschte Isomer lässt sich dann mit Diazabicycloundecen zum entsprechenden Weinlacton umsetzen.

Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d Stefano Serra, Claudio Fuganti: Natural p-Menthene Monoterpenes: Synthesis of the Enantiomeric Forms of Wine Lactone, Epi-wine Lactone, Dill Ether, and Epi-dill Ether Starting from a Common Intermediate. In: Helvetica Chimica Acta. Band 87, Nr. 8, August 2004, S. 2100–2109, doi:10.1002/hlca.200490189.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ H. Guth: Determination of the configuration of wine lactone. In: Helvetica Chimica Acta. Bd. 79, Ausgabe 6, 1996, S. 1559–1571; doi:10.1002/hlca.19960790606.
- ↑ a b H.-D. Belitz u. a.: Lehrbuch der Lebensmittelchemie. 5. Auflage. Springer, Berlin u. a. 2001, S. 343–345. (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Subhash P. Chavan, Rajendra K. Kharul, Anil K. Sharma, Sambhaji P. Chavan: An efficient and simple synthesis of (−)-wine lactone. In: Tetrahedron: Asymmetry. Band 12, Nr. 21, November 2001, S. 2985–2988, doi:10.1016/S0957-4166(01)00511-0.