Xenontetrachlorid
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
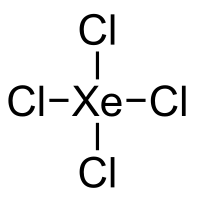
| ||||||||||
| Allgemeines | ||||||||||
| Name | Xenontetrachlorid | |||||||||
| Andere Namen |
Xenon(IV)-chlorid | |||||||||
| Summenformel | Cl4Xe | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 273,09 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||
Xenontetrachlorid ist eine instabile anorganische Verbindung mit der chemischen Formel XeCl4.[2] Im Gegensatz zu anderen Edelgas/Halogenid-Verbindungen kann es nicht durch einfaches Kombinieren der Elemente, durch Verwendung eines aktiveren Halogenierungsmittels oder durch Substitution von anderen Halogeniden an Tetrahalogenoxenon-Verbindungen synthetisiert werden. Stattdessen kann eine Zerfallstechnik angewendet werden, ausgehend von K129ICl4. Das Iod-129-Atom des 129ICl4 ist radioaktiv und zerfällt durch Betazerfall zu Xenon-129.[3][4] Das resultierende XeCl4-Molekül hat eine quadratische, planare Molekülgeometrie analog zu Xenontetrafluorid.[5]
Alternativ kann Xenontetrachlorid entstehen, wenn man die Elemente einer elektrischen Entladung aussetzt.[2]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ a b Egon Wiberg, Nils Wiberg, A. F. Holleman: Inorganic chemistry. 1st English ed Auflage. Academic Press ; De Gruyter, San Diego : Berlin ; New York 2001, ISBN 978-0-12-352651-9, S. 394 (englisch, loc.gov [abgerufen am 19. Juli 2021]).
- ↑ Colin Frank Bell: Syntheses and physical studies of inorganic compounds. [1st ed.]. Pergamon Press, Oxford 1972, ISBN 978-1-4832-8060-8, S. 143.
- ↑ A. H. Cockett: The Chemistry of the monatomic gases. Pergamon Press, Oxford 1975, ISBN 978-0-08-018782-2, S. 292.
- ↑ G. J. Perlow, M. R. Perlow: Mössbauer Effect Evidence for the Existence and Structure of XeCl4. In: Journal of Chemical Physics. Band 41, 1. August 1964, S. 1157–1158, doi:10.1063/1.1726022.