Yamaguchi-Verfahren
Das Yamaguchi-Verfahren, auch Yamaguchi-Cyclisierung oder Yamaguchi-Veresterung genannt, ist eine Namensreaktion aus der organischen Chemie. Sie dient zur Herstellung von Makroliden (auch Makrolactonen) aus leicht zugänglichen Hydroxycarbonsäuren. Makrolide besitzen vielfältige Anwendungen, etwa als Makrolidantibiotika oder Antimykotika. Die Reaktion der Hydroxycarbonsäure mit 2,4,6-Trichlorbenzoylchlorid führt in Anwesenheit einer stöchiometrischen Menge DMAP zu einer Zwischenstufe, die unter Abspaltung von 2,4,6-Trichlorbenzoesäure intramolekular den Ringschluss zum Endprodukt ausführt; das Verfahren wurde von Masaru Yamaguchi und Mitarbeitern entdeckt.[1][2]

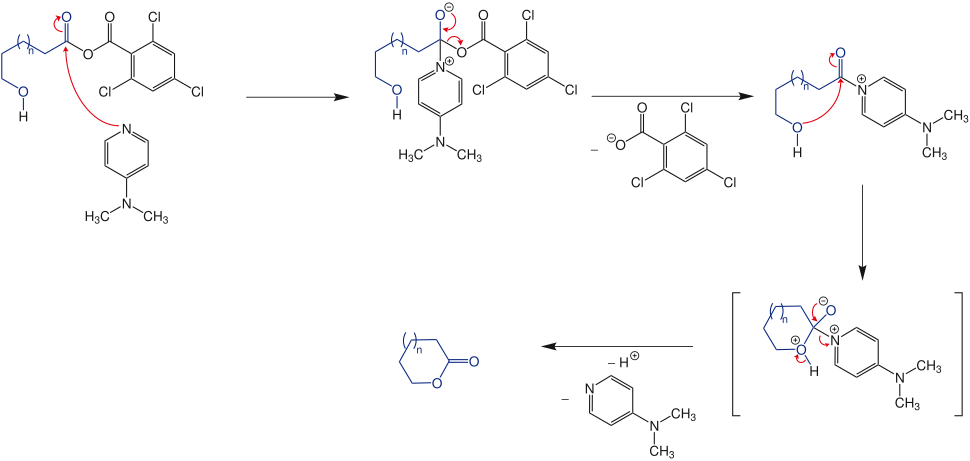
Mechanismus
[Bearbeiten | Quelltext bearbeiten]Die Säuregruppe wird durch Triethylamin deprotoniert. In einer nucleophilen Substitutionsreaktion greift die aktivierte ω-Hydroxycarbonsäure nun das Carbonsäurechlorid des 2,4,6-Trichlorbenzoesäurechlorids an. In der Reaktion entsteht über das tetraedische Intermediat ein gemischtes Anhydrid. Das hierbei freigesetzte Chlorid wird als Triethylaminhydrochlorid gebunden.

Die Anlagerung des DMAP an die sterisch ungehinderte Carbonylgruppe des Anhydrids bewirkt die Abspaltung von 2,4,6-Trichlorbenzoesäure als Nebenprodukt. Die Hydroxygruppe des Edukts greift nucleophil am stark positivierten Kohlenstoff der ursprünglichen Säuregruppe der Verbindung an. Der Ringschluss zum Lacton (Lactonisierung) erfolgt unter Abspaltung des katalytisch eingesetzten DMAP.
Anwendung
[Bearbeiten | Quelltext bearbeiten]Die Makrolactonisierung ist ein wichtiger Schritt bei der Synthese vieler Naturstoffe oder auch künstlicher Makrolide, die als Arzneistoffe einsetzbar sind. Ein praktisches Beispiel ist in der Synthese des Krebsmedikaments Epothilon A zu finden.
Literatur
[Bearbeiten | Quelltext bearbeiten]- J. Mulzer, Angew. Chem. 1991, 103, 1484, DOI:10.1002/ange.19911031108.
- D. Sawada, M. Shibasaki, Angew. Chem. 2000, 112, 215, doi:10.1002/(SICI)1521-3757(20000103)112:1<215::AID-ANGE215>3.0.CO;2-A.
- I. Dhimitruka, J. SantaLucia, Jr, Org. Lett., 2006, 8, 47–50, doi:10.1021/ol0524048.
- Nicolaou, K. C.; Sarabia, F.; Finlay, M. R. V.; Ninkovic, S.; King, N. P.; Vourloumis, D.; He, Y., Chem. Eur. J., 1997 3, 1971–1986, DOI:10.1002/chem.19970031212.
- Lee, J. Y.; Kim, B. H., Tetrahedron, 1996, 52, 571–588, DOI:10.1016/0040-4020(95)00913-2.
- Kürti, László und Czakó, Barbara: Strategic Applications of Named Reactions in Organic Synthesis; Elsevier Academic Press, Burlington-San Diego-London 2005, 1. Auflage; ISBN 0-12-369483-3.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Inanaga, J.; Hirata, K.; Saeki, H.; Katsuki, T.; Yamaguchi, M. "A Rapid Esterification by Means of Mixed Anhydride and Its Application to Large-ring Lactonization". Bull. Chem. Soc. Jpn. 1979, 52, 1989–1993. doi:10.1246/bcsj.52.1989.
- ↑ Kawanami, Y.; Dainobu, Y.; Inanaga, J.; Katsuki, T.; Yamaguchi, M. "Synthesis of Thiol Esters by Carboxylic Trichlorobenzoic Anhydrides". Bull. Chem. Soc. Jpn. 1981, 54, 943–944. doi:10.1246/bcsj.54.943.