2,5-Dihydroxy-1,4-benzochinon
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2,5-Dihydroxy-1,4-benzochinon | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C6H4O4 | ||||||||||||||||||
| Kurzbeschreibung |
gelbes bis gelbrotes Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 140,09 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,580 (25 °C, 589 nm)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2,5-Dihydroxy-1,4-benzochinon (DHBQ) ist ein 1,4-Benzochinon mit zwei Hydroxygruppen, dessen Diketon- und Hydroxy-Funktionalitäten jeweils para-ständig zueinander angeordnet sind. Die Verbindung wurde als eine der Hauptkomponenten bei der Alterung und Vergilbung von Cellulose identifiziert.[5]
Wegen seiner elektronischen und magnetischen Eigenschaften findet DHBQ Anwendungen in Metallkomplexen, MOFs und Akkumulatoren. Die Verbindung ist auch als Synthesebaustein (engl. building block), insbesondere für Farbstoffe und Pigmente, von Interesse.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Natürliches Vorkommen von DHBQ und seiner Derivate
[Bearbeiten | Quelltext bearbeiten]Der in Südasien (besonders Indien) vorkommende Falsche Pfeffer (Embelia ribes) enthält Embelin, ein in 3-Stellung mit einer C11-(Undecyl)-Kette substituiertes 2,5-Dihydroxy-1,4-benzochinon, dem ein breites Wirkspektrum als Antiphlogistikum, Analgetikum, Anthelminthikum und Antidiabetikum, und auch als Kontrazeptivum und Zytostatikum zugeschrieben wird.[6]
2,5-Dihydroxy-p-benzochinon kommt ubiquitär als chromophores Alterungsprodukt von Cellulose[5] vor. Seine Entfernung erfordert wegen der hohen Stabilität wirksame Bleichmittel und kontrollierte Prozessbedingungen, insbesondere auch zur möglichst vollständigen Eliminierung seines noch stabileren und farbintensiveren Oxidationsprodukts Rhodizonsäure.[7]
Von DHBQ abgeleitete phenylsubstituierte 1,4-Benzochinone sind als Pilzfarbstoffe, wie z. B. Polyporsäure und Atromentin, sowie die orangeroten Bovichinone, identifiziert worden.
Chemische Darstellung von DHBQ
[Bearbeiten | Quelltext bearbeiten]Oxidation des farblosen 2,5-Diaminohydrochinon-dihydrochlorids erzeugt das violette 2,5-Diamino-1,4-benzochinon, das beim Erhitzen in wässriger Lösung in das gelbrote 2,5-Dihydroxy-1,4-benzochinon übergeht.[8]

Der kürzeste Syntheseweg zu 2,5-Dihydroxy-1,4-benzochinon geht aus von Hydrochinon (1,4-Dihydroxybenzol), das in konzentrierter Natronlauge mit 30 %igem Wasserstoffperoxid H2O2 zum roten DHBQ-Natriumsalz oxidiert wird. Beim Ansäuern fällt das gelbe Zielprodukt in 66 bis 70 % Ausbeute an.[9]

Optimierte Bedingungen für diesen Prozess liefern reines DHBQ als gelber Feststoff in deutlich höherer Ausbeute (83,8 %).[3]
Eigenschaften
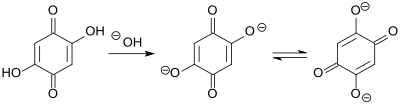
[Bearbeiten | Quelltext bearbeiten]2,5-Dihydroxy-1,4-benzochinon ist ein gelber Feststoff, der sich wenig in Wasser, aber gut in Aceton und Ethanol löst. Bei basischem pH-Wert (pH > 10) löst sich die Verbindung sehr gut als rotes Diphenolat-Dianion. DHBQ ist deutlich sauer (Säurekonstante pKS 2,71[7] gegenüber Essigsäure 4,76) und wegen der Resonanzstabilisierung des Dianions sehr beständig gegenüber Oxidationsmitteln, wie z. B. Wasserstoffperoxid, Sauerstoff oder Ozon.[10][7]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]2,5-Dihydroxy-1,4-benzochinon kann in Haarfärbemitteln eingesetzt werden und verleiht den damit behandelten Haaren eine als „rötliches Mahagoni“ beschriebene Färbung.[11]
DHBQ als Synthesebaustein
[Bearbeiten | Quelltext bearbeiten]2,5-Dihydroxy-1,4-benzochinon zeigt gegenüber Nukleophilen ein interessantes Reaktionsverhalten. An 13C-markiertem DHBQ konnte gezeigt werden, dass sekundäre Amine, wie z. B. Morpholin, in einer nukleophilen Substitution die beiden Hydroxygruppen verdrängen (Reaktionsweg A.),
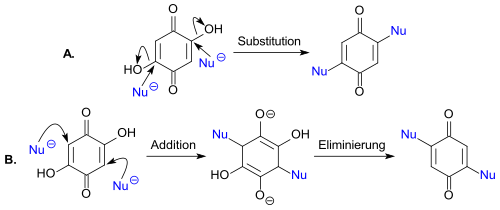
während Thiole wie Thiophenol in einer Additions-Eliminierungsreaktion (Reaktionsweg B.) mit DHBQ reagieren.[12]
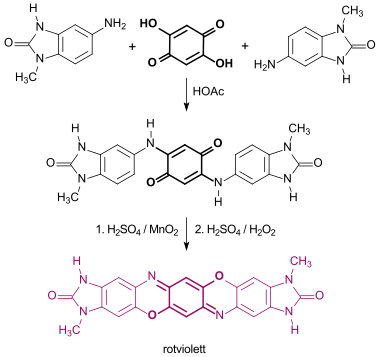
Kondensation von 2,5-Dihydroxy-1,4-benzochinon mit substituierten Benzimidazolonen erzeugt rote bis violette Benzimidazolonpigmente, die sich zur dauerhaften Einfärbung von Polymeren eignen.[13]
Hydrierung von 2,5-Dihydroxy-1,4-benzochinon in Tetrahydrofuran mit Platin(IV)-oxid erzeugt das extrem sauerstoffempfindliche 1,2,4,5-Tetrahydroxybenzol (Benzol-1,2,4,5-tetrol) als weißes Kristallpulver, das sich an der Luft durch Oxidation zum Ausgangsstoff DHBQ rasch orange färbt.[3]

In den letzten Jahren im Fokus intensiver Forschungen stehende metallorganische Gerüstverbindungen (MOFs) können durch Erhitzen von DHBQ mit z. B. Nickel(II)-acetat Ni(OAc)2 und Tetrabutylammoniumbromid NBu4Br in quantitativer Ausbeute erzeugt werden.[8]
DHBQ in Akkumulatoren
[Bearbeiten | Quelltext bearbeiten]Das Redoxsystem DHBQ / DHBQ-Dianion mit dem chemisch und thermisch recht stabilen Dianion macht 2,5-Dihydroxy-1,4-benzochinon für elektrochemische Anwendungen interessant. So wurde das Dinatriumsalz des 2,5-Dihydroxy-1,4-benzochinons als Anodenmaterial für wiederaufladbare Natrium-Ionen-Akkumulatoren untersucht.[14]
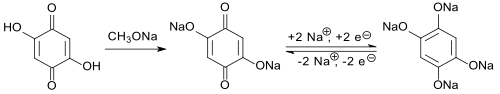
Die angegebene reversible Kapazität von ca. 265 mAh·g-1 ist für Natriumionenanoden relativ hoch, die gemessenen Zyklen mit 300 aber vergleichsweise niedrig.
Als nachteilig hat sich die relativ gute Löslichkeit von DHBQ in sauren Elektrolyten erwiesen, die zu einem raschen Kapazitätsverlust bereits nach geringer Zyklenzahl führt.[15]
Aus dem Polymer von DHBQ mit Formaldehyd und Acetylenruß können positive Elektroden für wiederaufladbare Lithiumbatterien gebaut werden,
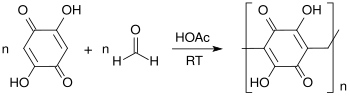
die mit weniger als 10 % Abbau in den ersten 100 Zyklen eine eher bescheidene Zyklenfestigkeit zeigten.[16]
Das DHBQ-Polymer – Poly(2,5-dihydroxy-1,4-benzochinon-3,6-methylen) – wurde auch als Anode eines Polymer-Luft-Akkumulators mit einem Säureelektrolyten und einer Platin-Kathode mit ersten brauchbaren Ergebnissen getestet.[17]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu 2,5-Dihydroxy-1,4-benzoquinone bei TCI Europe, abgerufen am 18. Juli 2020.
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 95.
- ↑ a b c Patent US3780114: Method for the preparation of 1,2,4,5-tetrahydrobenzene. Angemeldet am 23. November 1970, veröffentlicht am 18. Dezember 1973, Anmelder: S.A. Texaco Belgium N.V., Erfinder: S.A.R. Dewaele.
- ↑ a b Datenblatt 2,5-Dihydroxy-1,4-benzochinon bei Sigma-Aldrich, abgerufen am 18. Juli 2020 (PDF).
- ↑ a b T. Hosoya, A.D. French, T. Rosenau: Chemistry of 2,5-dihydroxy-[1,4]-benzoquinone, a key chromophore in aged cellulosics. In: Mini-Rev. Org. Chem. Band 10, Nr. 3, 2013, S. 309–315, doi:10.2174/1570193X11310030009.
- ↑ A. Dadwal, N. Mishra, S. Sharma: Embelin, a promising component of embelia ribes Burm F: An overview. LAP Lambert Academic Publishing, 2016, ISBN 978-3-659-89619-4 (englisch).
- ↑ a b c M. Guggenberger et al.: Degradation of the cellulosic key chromophore 2,5-dihydroxy-[1,4]-benzoquinone (DHBQ) under conditions of chlorine dioxide pulp bleaching: formation of rhodizonate as secondary chromophore – a combined experimental and theoretical study. In: Cellulose. Band 27, 2020, S. 3623–3649, doi:10.1007/s10570-020-03014-y.
- ↑ a b K.V. Nielson, L. Zhang, Q. Zhang, T.L. Liu: A strategic high yield synthesis of 2,5-dihydroxy-1,5-benzoquinone based MOFs. In: Inorg. Chem. Band 58, Nr. 16, 2019, S. 10756–10760, doi:10.1021/acs.inorgchem.9b00903.
- ↑ R.G. Jones, H.A. Shonle: The preparation of 2,5-dihydroxyquinone. In: J. Am. Chem. Soc. Band 67, Nr. 6, 1945, S. 1034–1039, doi:10.1021/ja01222a504.
- ↑ Z. Yang, L. Tong, D.P. Tabor, E.S. Beh, M.-A. Goulet, D. De Porcellinis, A. Asperu-Guzik, R.G. Gordon, M.J. Aziz: Alkaline benzoquinone aqueous flow battery for large-scale storage of electrical energy. In: Adv. Energy Mater. 2017, S. 1702056, doi:10.1002/aenm.201702056.
- ↑ Patent WO2003042199A1: Mittel und Verfahren zum Färben von Keratinfasern enthaltend 2-Benzthiazolinon-hydrazon und Chinon-Derivate. Angemeldet am 22. August 2002, veröffentlicht am 22. Mai 2003, Anmelder: Wella AG, Erfinder: C. Pasquier, G. Umbricht, V. Buclin-Charrière, S. Oberson, H.-J. Braun.
- ↑ H. Hettegger, K. Steinkellner, N.S. Zwirchmayr, A. Potthast, K.J. Edgar, T. Rosenau: Reaction of 2,5-dihydroxy-[1,4]-benzoquinone with nucleophiles – ipso-substitution vs. addition/elimination. In: Chem. Commun. Band 56, Nr. 84, 2020, S. 12845–12845, doi:10.1039/D0CC04748A.
- ↑ Patent EP1132432B1: Verfahren zur Herstellung von Pigmenten. Angemeldet am 5. März 2001, veröffentlicht am 8. Februar 2006, Anmelder: Clariant GmbH, Erfinder: B.L. Kaul, B. Piastra, P. Steffanut.
- ↑ Z. Zhu, H. Li, J. Liang, Z. Tao, J. Chen: The disodium salt of 2,5-dihydroxy-1,4-benzoquinone as anode material for rechargeable sodium ion batteries. In: Chem. Commun. Band 51, Nr. 8, 2015, S. 1446–1448, doi:10.1039/C4CC08220F.
- ↑ Y. Liang, Y. Jing, S. Gheytani, K.-Y. Lee, P. Liu, A. Facchetti, Y. Yao: Universal quinone electrodes for long cycle life aqueous rechargeable batteries. In: Nature Mater. Band 16, 2017, S. 841–848, doi:10.1038/nmat4919.
- ↑ T. Le Gill, K.H. Reiman, M.C. Grossel, J.R. Owen: Poly(2,5-dihydroxy-1,4-benzoquinone-3,6-methylene): a new organic polymer as positive electrode material for rechargeable lithium batteries. In: J. Power Sci. Band 119–121, 2003, S. 316–320, doi:10.1016/S0378-7753(03)00167-8.
- ↑ K. Oka, S. Furukawa, S. Murao, T. Oka, H. Nishide, K. Oyaizu: Poly(dihydroxybenzoquinone): its high-density and robust charge storage capability in rechargeable acidic polymer-air batteries. In: Chem. Commun. Band 56, Nr. 29, 2020, S. 4055–4058, doi:10.1039/D0CC00660B.
