2-Aminobenzimidazol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Aminobenzimidazol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H7N3 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 133,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (< 1 g·cm−3 bei 20 °C)[2], löslich in Ethanol und Aceton, wenig löslich in Diethylether, Benzol und DMSO[4] | ||||||||||||||||||
| Brechungsindex |
1,5341 (25 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Aminobenzimidazol ist eine chemische Verbindung, die aus einem Benzolring und einem anellierten Imidazolring besteht und in 2-Stellung (d. h. zwischen den beiden Stickstoffatomen des Imidazols) eine Aminogruppe trägt. Dieser funktionelle bicyclische Heteroaromat ist Ausgangsstoff einer Vielzahl von physiologisch aktiven Substanzen[5], von pilz- und wurmabtötenden Mitteln bis zu auch gegen Problemkeime, wie z. B. Pseudomonas aeruginosa, wirksamen Wirkstoffen.[6]
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Herstellung von 2-Aminobenzimidazol wurde erstmals 1908 aus dem außerordentlich giftigen Bromcyan und 1,2-Phenylendiamin berichtet.[7]

Wesentlich besser eignet sich die Synthese mit Cyanamid (statt Bromcyan) in wässriger Lösung, aus der 2-Aminobenzimidazol in 92-prozentiger Ausbeute in hellbraunen Blättchen ausfällt.[8]
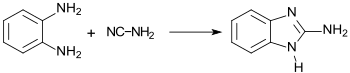
Weitere Synthesevarianten sind beschrieben, aber eher für am Benzolring substituierte Derivate im Labormaßstab geeignet.[5]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]2-Aminobenzimidazol ist ein schlecht wasserlöslicher Feststoff, der in Reinsubstanz in weißen Blättchen kristallisiert.[4] In polaren Lösungsmitteln, wie z. B. in Aceton und Ethanol, oder in Alkali löst er sich leicht.
Das Tautomerie-Gleichgewicht liegt entgegen der in der Erstpublikation von 1908 geäußerten Vermutung nicht auf Seiten des franz. orthophénylèneguanidine genannten Imids, sondern weit auf Seiten des Amins 2-Aminobenzimidazol.[9]

1H-Benzimidazol-2-amin erscheint auch als bakterielles Abbauprodukt der (in der EU obsoleten) Fungizide Carbendazim und Benomyl im Boden.[10]
Anwendungen
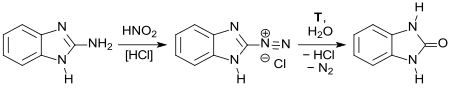
[Bearbeiten | Quelltext bearbeiten]Wie bereits in der Erstpublikation 1908 berichtet, entsteht aus 1H-Benzimidazol-2-amin durch Diazotierung mit Salpetriger Säure HNO2 und anschließende Verkochung Benzimidazolon (Hydroxybenzimidazol, hier als „orthophénylèneurée“ bezeichnet).[11]
Die Reaktion von 2-Aminobenzimidazol mit Hydroxylamin-O-sulfonsäure HOSA liefert 1,2-Diaminobenzimidazol (75 Prozent Ausbeute),
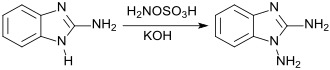
das antikorrosive Eigenschaften aufweist und dessen Derivate auf ihre Eignung als antibakteriell und antimykotisch wirksame Arzneistoffe untersucht wurden.[12]
Mit dem aus Phthalsäureanhydrid und Harnstoff zugänglichen 1,3-Diiminoisoindolin und 2-Aminobenzimidazol erhält man einen gelben Farbstoff, z. B. für Polyesterfasern.[13]

Mit Dicarbonylverbindungen bildet 2-Aminobenzimidazol leicht kondensierte Heterocyclen. So entsteht z. B. mit Acetylendicarbonsäuredimethylester ein Dihydropyrimido[1,2-a]benzimidazol.

2-Aminobenzimidazol ist Strukturelement einer größeren Zahl von Funktionschemikalien im Bereich von Fungiziden, wie z. B. Carbendazim, Benomyl, von Anthelmintika, wie z. B. Mebendazol, Fenbendazol, Oxfendazol,[S 1] Albendazol und Flubendazol, sowie von Antibiotika gegen multiresistente MRSA-Keime.[14]
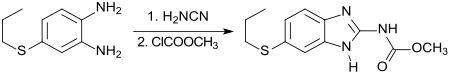
Eine gängige Route zum Aufbau dieser Verbindungen ist die Synthese eines (meist in 5-Stellung) abgewandelten 1,2-Phenylendiamins, dessen Ringschluss mit Cyanamid zum entsprechenden 2-Aminobenzimidazol und anschließende Derivatisierung an der Aminogruppe zum Endprodukt, wie z. B. bei dem Wurmmittel Albendazol.[15]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Eintrag zu 2-Aminobenzimidazole bei TCI Europe, abgerufen am 30. Mai 2020.
- ↑ a b c d e f Datenblatt 2-Aminobenzimidazol zur Synthese bei Merck, abgerufen am 30. Mai 2020.
- ↑ a b Carl L. Yaws: Thermophysical Properties of Chemicals and Hydrocarbons, 2nd Edition. Elsevier Inc., Oxford, UK 2015, ISBN 978-0-323-28659-6, S. 149.
- ↑ a b William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–38.
- ↑ a b R. Rastogi, S. Sharma: 2-Aminobenzimidazole in Organic Syntheses. In: Synthesis. Band 11, 1983, S. 861–882, doi:10.1055/s-1983-30546.
- ↑ R. Frei, A.S. Breitbach, H.E. Blackwell: 2-Aminobenzimidazole derivatives strongly inhibit and disperse Pseudomonas aeruginosa biofilms. In: Angew. Chem. Int. Ed. Band 51, Nr. 21, 2012, S. 5226–5229, doi:10.1002/anie.201109258.
- ↑ P. Pierron: Sur les cyanamides aromatiques monoatomiques. In: Ann. Chim. Phys. Band 15, Nr. 8, 1908, S. 189–193 (bnf.fr).
- ↑ S. Weiss, H. Michaud, H. Prietzel, H. Krommer: Neue, einfache Synthese von 2-Aminobenzimidazol. In: Angew. Chem. Band 85, Nr. 19, 1973, S. 866–867, doi:10.1002/ange.19730851910.
- ↑ J. Backes, B. Heinz, W.G. Ried: Houben-Weyl: Methoden der Organischen Chemie, 4. Auflage. E 8c. Thieme, Stuttgart 1994, ISBN 978-3-13-797804-6, S. 219.
- ↑ Gerhard Eisenbrand, Alfred Hagen Meyer, Peter Schreier: RÖMPP Lexikon Lebensmittelchemie, 2. Aufl. Thieme Verlag, Stuttgart 2006, ISBN 978-3-13-736602-7, S. 405.
- ↑ P. Pierron: Sur les cyanamides aromatiques monoatomiques. In: Ann. Chim. Phys. Band 15, Nr. 8, 1908, S. 195 (bnf.fr).
- ↑ D. Vlaović, J. Čanadanović-Brunet, J. Balaž, I. Juranić, D. Djoković, K. Mackenzie: Synthesis, AntiBacteriol, and Antifungal Activities of Some New Benzimidazoles. In: Biosci. Biotech. Bioch. Band 56, Nr. 2, 1992, S. 199–206, doi:10.1271/bbb.56.199.
- ↑ Patent US3499908: Production of 1,3-bis(heterocycloimino)-isoindolines from 3-iminoisoindolenines and heterocyclic amines. Angemeldet am 14. November 1966, veröffentlicht am 10. März 1970, Anmelder: Farbenfabriken Bayer AG, Erfinder: H. Vollmann, H. Leister.
- ↑ R.W. Huisgens III, S. Reyes, C.S. Reed, C. Bunders, S.A. Rogers, A.T. Steinhauer, C. Melander: The chemical synthesis and antibiotic activity of a diverse library of 2-aminobenzimidazole small molecules against MRSA and multidrug-resistant A. baumannii. In: Bioorg. Med. Chem. Band 18, Nr. 2, 2010, S. 663–674, doi:10.1016/j.bmc.2009.12.003.
- ↑ Ruben Vardanyan, Victor Hruby: Synthesis of Essential Drugs. Elsevier Science, 2006, ISBN 978-0-444-52166-8, S. 585.
Anmerkungen
[Bearbeiten | Quelltext bearbeiten]- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Oxfendazol: CAS-Nr.: 53716-50-0, EG-Nr.: 258-714-5, ECHA-InfoCard: 100.053.358, PubChem: 40854, ChemSpider: 37316, DrugBank: DBDB11446, Wikidata: Q7115199.
