2-Methylcyclohexanol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
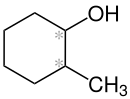
| |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie (* = Stereozentrum) | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Methylcyclohexanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C7H14O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit campherartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 114,19 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,462 (20 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
2-Methylcyclohexanol ist eine chemische Verbindung aus der Gruppe der Cyclohexanolderivate, zählt also zu den Alkoholen.
Stereoisomerie
[Bearbeiten | Quelltext bearbeiten]2-Methylcyclohexanol besitzt zwei Stereozentren, somit existieren vier Stereoisomere:
- (1S,2R)-2-Methylcyclohexanol
- (1R,2S)-2-Methylcyclohexanol
- (1R,2R)-2-Methylcyclohexanol
- (1S,2S)-2-Methylcyclohexanol
| Isomere von 2-Methylcyclohexanol | ||||
| Exakter Name | (1S,2R)-2-Methylcyclohexanol | (1R,2S)-2-Methylcyclohexanol | (1R,2R)-2-Methylcyclohexanol | (1S,2S)-2-Methylcyclohexanol |
| Strukturformel | 
|

|

|

|
Eine Mischung aus (1S,2R)-2-Methylcyclohexanol und (1R,2S)-2-Methylcyclohexanol wird cis-2-Methylcyclohexanol genannt. trans-2-Methylcyclohexanol ist eine Mischung aus (1R,2R)-2-Methylcyclohexanol und (1S,2S)-2-Methylcyclohexanol.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]trans-2-Methylcyclohexanol kann durch Hydroborierung von Methylcyclohexen gewonnen werden.[6] Eine Mischung aus 75 % cis-2-Methylcyclohexanol und 25 % trans-2-Methylcyclohexanol kann durch Reduktion von 2-Methylcyclohexanon mit Lithiumtriethylborhydrid gewonnen werden.[7]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die Verbindung ist eine farblose Flüssigkeit mit campherartigem Geruch, die schwer löslich in Wasser ist.[1]
Verwendung
[Bearbeiten | Quelltext bearbeiten]2-Methylcyclohexanol wird verwendet, um die Wirkung von organischen Lösungsmitteln auf die Epoxidhydrolase zu untersuchen.[3] Es wird auch bei der Herstellung von Essigsäure-(2-methyl-cyclohexylester) durch Reaktion mit Essigsäureanhydrid verwendet.[8]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Die Dämpfe von 2-Methylcyclohexanol können mit Luft ein explosionsfähiges Gemisch (Flammpunkt 58 °C, Zündtemperatur 295 °C) bilden.[1]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n o p q Eintrag zu 2-Methylcyclohexanol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Januar 2019. (JavaScript erforderlich)
- ↑ David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 378 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ a b Datenblatt 2-Methylcyclohexanol, mixture of cis and trans, 99% bei Sigma-Aldrich, abgerufen am 12. Januar 2019 (PDF).
- ↑ Eintrag zu 2-methylcyclohexanol, mixed isomers im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Januar 2019. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ BAuA: Begründung zu Methylcyclohexanol in TRGS 900, Juni 2008, abgerufen am 12. Januar 2019.
- ↑ Marye Anne Fox, James K. Whitesell: Organic Chemistry. Jones & Bartlett Learning, 2004, ISBN 978-0-7637-2197-8, S. 498 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Herbert C. Brown, S. C. Kim, S. Krishnamurthy: Selective reductions. 26. Lithium triethylborohydride as an exceptionally powerful and selective reducing agent in organic synthesis. Exploration of the reactions with selected organic compounds containing representative functional groups. In: The Journal of Organic Chemistry. 45, 1980, S. 1, doi:10.1021/jo01289a001.
- ↑ Datenblatt 2-Methylcyclohexanol, cis + trans, 97% bei Alfa Aesar, abgerufen am 12. Januar 2019 (Seite nicht mehr abrufbar).

