3-Thujole
| 3-Thujole | |||||
| Name | (−)-3-Thujol | (+)-3-Isothujol | (−)-3-Neothujol | (+)-3-Neoisothujol | |
| Strukturformel | 
|
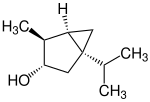
|

|

| |
| CAS-Nummer | 35732-37-7 | 35732-36-6 | 31187-53-8 | 35732-34-4 | |
| PubChem | 90658274 | ||||
| ChemSpider | 10110 | ||||
| Summenformel | C10H18O | ||||
| Molare Masse | 154,14 g·mol−1 | ||||
| GHS- Kennzeichnung |
| ||||
| H- und P-Sätze | H: siehe oben | ||||
| EUH: siehe oben | |||||
| P: siehe oben | |||||
3-Thujole (auch 3-Thujanole) sind eine Gruppe stereoisomerer Terpenalkohole. Von den 4-Thujolen unterscheiden sie sich durch die Position der Hydroxylgruppe.
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Iso-3-thujol ist der Hauptbestandteil des ätherischen Öls der Laugenblume Cotula cinerea. Auch Neo-3-thujol und Neoiso-3-thujol sowie Acetate mehrerer 3-Thujole kommen in der Pflanze vor.[1] Neoiso-3-thujol kommt in der Kronenwucherblume vor.[2]
Gewinnung
[Bearbeiten | Quelltext bearbeiten]Durch Reduktion von (−)-α-Thujon können 3-Thujol und Neo-3-thujol gewonnen werden. Im Allgemeinen entstehen dabei beide Diastereomere, jedoch kann durch geeignete Reaktionsbedingungen ein hoher Enantiomerenüberschuss erzielt werden. Mit Aluminiumtriisopropanolat in Isopropanol am Rückfluss entsteht 87 % 3-Thujol, mit Lithiumaluminiumhydrid in Diethylether bei −78 °C entsteht 89 % Neo-3-thujol. Analog können Iso-3-thujol und Neoiso-3-thujol durch Reduktion von (+)-β-Thujon gewonnen werden. Auch in diesem Fall hängt der Enantiomerenüberschuss stark von den Reaktionsbedingungen ab. In den meisten Fällen entsteht bevorzugt Neoiso-3-thujol, zum Beispiel 88 % mit Aluminium-sec-butanolat in sec-Butanol am Rückfluss.[3]
Verwendung
[Bearbeiten | Quelltext bearbeiten](−)-3-Thujol ist in der EU unter der FL-Nummer 02.207 als Aromastoff für Lebensmittel allgemein zugelassen.[4]
(−)-3-Thujol kann als Ausgangspunkt für die Synthese von trans-4-Thujol verwendet werden.[5]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Ekhlil, Boussola et al.: Chemical quality, antibacterial and antifungal activities of Cotula cinerea essential oil from South Morocco. (2016).
- ↑ K. Tawaha, M. Hudaib: Volatile oil profiles of the aerial parts of Jordanian garland, Chrysanthemum coronarium. In: Pharmaceutical Biology. Band 48, Nr. 10, Oktober 2010, S. 1108–1114, doi:10.3109/13880200903505641.
- ↑ D. V. Banthorpe, H. ff. S. Davies: Stereochemistry of reduction of (–)-thujone and (—)-isothujone. In: J. Chem. Soc. B. Band 0, Nr. 0, 1968, S. 1356–1360, doi:10.1039/J29680001356.
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 15. Oktober 2023.
- ↑ Peter Baeckström, Bohumir Koutek, David Šaman, Jan Vrkoč: A convenient synthesis of trans-sabinene hydrate from (−)-3-thujol via a highly selective ene reaction of singlet oxygen. In: Bioorganic & Medicinal Chemistry. Band 4, Nr. 3, März 1996, S. 419–421, doi:10.1016/0968-0896(96)00020-X.