4-Hydroxyacetophenon
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 4-Hydroxyacetophenon | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | C8H8O2 | ||||||||||||||||||
| Kurzbeschreibung | |||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 136,15 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
wenig löslich in Wasser (9,9 g·l−1 bei 22 °C[3]) und in DMSO[4], sehr gut löslich in Methanol[2], Ethanol und Diethylether[4] | ||||||||||||||||||
| Brechungsindex |
1,5577 (109 °C, 589 nm)[4] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
4-Hydroxyacetophenon ist ein Phenol, das in para-Stellung eine Acetylgruppe trägt. 4-HAP kommt natürlich in vielen Pflanzengattungen vor, wo es in einer Reaktion auf Pflanzenstress über die in Pflanzen ubiquitäre Zwischenstufe Coumaroyl-CoA gebildet wird. Es wirkt u. a. als Antioxidans und findet als Ausgangsstoff für Monomere und Arzneistoffe Verwendung.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Besonders häufig tritt 4-Hydroxyacetophenon in Fichten, z. B. der Gemeinen Fichte (Picea abies)[6] – daher auch der Name Piceol – und in Artemisia-Arten, wie z. B. Artemisia herba-alba, auf und wirkt als Abwehrstoff gegen Mikroorganismen und tierische Schädlinge.
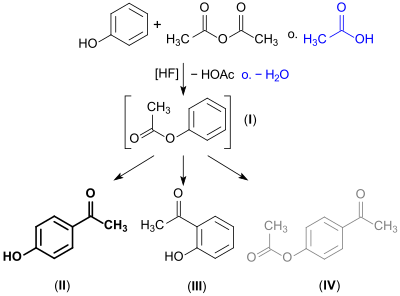
Bei der industriellen chemischen Synthese von 4-Hydroxyacetophenon reagiert Phenol mit Essigsäure oder bevorzugt mit Acetanhydrid in Gegenwart von wasserfreiem Fluorwasserstoff (HF) oder Flusssäure als Lösungsmittel und Acylierungskatalysator – anstelle des in stöchiometrischen Mengen erforderlichen und problematischen Abfall erzeugenden Aluminiumchlorids AlCl3 – zunächst unter Bildung des Esters Phenylacetat (I), der durch Fries-Umlagerung in 4-Hydroxyacetophenon (II) übergeht. Daneben werden als Nebenprodukt (< 10 %) das isomere 2′-Hydroxyacetophenon (III) und Spuren von 4-Acetoxyacetophenon (4-Acetylphenylacetat) (IV)[7] gebildet.[8]
Das Arbeiten mit HF und Flusssäure als Lösungsmittel und dessen Recycling erfordern wegen der hohen Giftigkeit und Korrosivität komplexe Prozesse und teure Apparaturen aus speziellen Werkstoffen, wie z. B. Hastelloy C-276 und Oberflächenbeschichtungen aus Fluorpolymeren, z. B. Teflon.[9]
Da das Produkt 4-HAP hartnäckig HF festhält, muss dieses durch Destillation mit z. B. n-Hexan entfernt werden.[10] Die Abtrennung von unerwünschten Verunreinigungen erfolgt mittels (mehrfacher) Umkristallisation aus z. B. Ethanol-Wasser-Gemischen.[11]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Reines 4-Hydroxyacetophenon ist ein weißes Kristallpulver, das sich gut in niederen Alkoholen und Diethylether löst. Angaben zum Geruch variieren zwischen geruchlos[11] und blumig.[12] Die Substanz ist leicht biologisch abbaubar und unter FEMA/GRAS # 4330 (GRAS = engl. generally recognized as safe) für den Einsatz in Lebensmitteln zugelassen.[13]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]4-Hydroxyacetophenon besitzt oxidationshemmende, pilzabtötende und bakterienwachstumshemmende Eigenschaften[11] und wird daher zur Stabilisierung kosmetischer Zubereitungen eingesetzt.[14]
4-Vinylphenol (4-Hydroxystyrol)[15] ist durch eine mehrstufige Reaktionsfolge aus 4-Hydroxyacetophenon (II) zugänglich. Zunächst wird 4-HAP mit Acetanhydrid zu 4-Acetoxyacetophenon (IV) acetyliert. Bei der katalytischen Hydrierung von (IV) entsteht 4-Acetoxyphenylmethylcarbinol (V), das bei Erhitzen unter Wasserabspaltung in 4-Acetoxystyrol (4-Vinylphenylacetat) (VI) übergeht.[16] Abschließend kann die Acetylgruppe unter Basen- oder Säurekatalyse zum Zielprodukt 4-Hydroxystyrol (VII) hydrolysiert werden.[17]

Radikalische Polymerisation von 4-Vinylphenol erzeugt Poly(4-hydroxystyrol), das als Harzbindemittel in Photoresists verwendet wird. Da bei der Polymerisation von 4-Hydroxystyrol durch Abstraktion von Wasserstoff von der phenolischen Hydroxylgruppe Kettenabbruchreaktionen induziert und so niedrigere Molmassen und breitere Molmassenverteilungen erzeugt werden, polymerisiert man häufig die Vorstufe 4-Acetoxystyrol (VI) und entfernt anschließend die Acetylschutzgruppe durch polymeranaloge Reaktion.
Eine siebenstufige Synthese für das β-2-Sympathomimetikum Salbutamol (Albuterol) geht ebenfalls aus von 4-Hydroxyacetophenon und liefert das Racemat.[18]
Der Neurotransmitter Octopamin wird durch Reaktion von 4-HAP mit Amylnitrit oder besser tert-Butylnitrit in Gegenwart von Chlorwasserstoff zum 4-Hydroxyisonitrosoacetophenon und nachfolgender katalytischer Hydrierung erhalten. Unter forcierten Hydrierbedingungen entsteht Tyramin, das Decarboxylierungsprodukt der Aminosäure Tyrosin.[19][20]

Eine Standardroute zum peripheren Vasodilatans Bamethan basiert ebenfalls auf 4-Hydroxyacetophenon, das zunächst durch Benzoylierung geschützt, an der Methylgruppe bromiert, mit n-Butylamin zum sekundären Amin umgesetzt und abschließend an einem Palladium-Kontakt zum racemischen Endprodukt hydriert wird.[21]

Das auch natürlich vorkommende Methylhomologe Synephrin (Oxedrin) ist in analoger Weise aus 4-HAP zugänglich, aber wegen zweifelhafter Wirkung und problematischer Nutzung obsolet.[22]
Alkylierung von 4-HAP z. B. mit 1-Brombutan erzeugt 4-Butoxyacetophenon[23], aus dem das Lokalanästhetikum Dyclonin zugänglich ist.
Das Analgetikum Paracetamol kann in einem industriellen Prozess auch aus 4-Hydroxyacetophenon durch Reaktion mit Bis(hydroxylammonium)sulfat (NH3OH)2SO4 zum Oxim und nachfolgende Beckmann-Umlagerung zum 4-Acetaminophenol (Acetaminophen) hergestellt werden.[24]

Das Verfahren erwies sich jedoch wegen hoher Investitions- und Umweltkosten (z. B. für die Entsorgung des Sulfats aus dem Hydroxylammoniumsulfat) als nicht wettbewerbsfähig. Eine im Jahr 1990 von der Hoechst Celanese Corp. in Bishop, TX in Betrieb genommene Anlage mit einer Kapazität von 9.000 Jahrestonnen wurde 2001 stillgelegt.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu HYDROXYACETOPHENONE in der CosIng-Datenbank der EU-Kommission, abgerufen am 9. April 2022.
- ↑ a b Eintrag zu 4'-Hydroxyacetophenone bei TCI Europe, abgerufen am 29. März 2022.
- ↑ a b c d e f g Eintrag zu 4′-Hydroxyacetophenone in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Februar 2023. (JavaScript erforderlich)
- ↑ a b c d William M. Haynes: CRC Handbook of Chemistry and Physics, 96th Edition. CRC Press, Boca Raton, FL, U.S.A. 2015, ISBN 978-1-4822-6097-7, S. 3–314.
- ↑ a b c d e Datenblatt 4′-Hydroxyacetophenon, 99 % bei Sigma-Aldrich, abgerufen am 29. März 2022 (PDF).
- ↑ H. Løkke: Picein and piceol concentrations in Norway spruce. In: Ecotoxicol. Environ. Saf. Band 19, Nr. 3, 1990, S. 301–309, doi:10.1016/0147-6513(90)90032-z.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu p-acetylphenyl acetate: CAS-Nr.: 13031-43-1, EG-Nr.: 235-894-3, ECHA-InfoCard: 100.032.617, PubChem: 83063, ChemSpider: 74935, Wikidata: Q27159244.
- ↑ Patent EP0167286A1: Process for producing 4-hydroxyacetophenone. Angemeldet am 3. Juni 1985, veröffentlicht am 8. Januar 1986, Anmelder: Celanese Corp., Erfinder: K.G. Davenport, C.B. Hilton, G.N. Mott, D.L. Keene.
- ↑ RECOMMENDATION ON MATERIALS OF CONSTRUCTION FOR ANHYDROUS HYDROGEN FLUORIDE (AHF) AND HYDROFLUORIC ACID SOLUTIONS (HF). Eurofluor, 2. November 2017, abgerufen am 1. April 2022.
- ↑ Patent US4663485: Process for purifying 4-hydroxyacetophenone. Angemeldet am 22. Juli 1986, veröffentlicht am 5. Mai 1987, Anmelder: Celanese Corp., Erfinder: C.D. Murphy, D.L. Keene, D.D. Lindley.
- ↑ a b c Patent WO2018068902A1: Method for purification of 4-hydroxyacetophenone. Angemeldet am 21. April 2017, veröffentlicht am 19. April 2018, Anmelder: Symrise AG, Sino-High (China) Co. Ltd., Erfinder: R. Pillai, S. Siegel, E. Suess, K. Bolte, Y. Liuxin.
- ↑ George A. Burdock: Fenaroli’s Handbook of Flavor Ingredients, 6th Edition. CRC Press, Boca Raton, FL, U.S.A. 2010, ISBN 978-1-4200-9077-2, S. 908.
- ↑ GRAS Flavoring Substances 23. In: food technology. FEMA Expert Panel, August 2007, abgerufen am 2. April 2022.
- ↑ Patent EP3122316B1: Öl in Wasser-Emulsionen mit einem Gehalt an 4-Hydroxyacetophenon und anionischen Emulgatoren. Angemeldet am 27. Januar 2015, veröffentlicht am 27. Juni 2018, Anmelder: Symrise AG, Erfinder: J. Pruns, T. Raschke, B. Nissen.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 4-Vinylphenol: CAS-Nr.: 2628-17-3, EG-Nr.: 220-103-6, ECHA-InfoCard: 100.018.276, PubChem: 62453, ChemSpider: 56234, Wikidata: Q4637201.
- ↑ Patent US5274175A: Process for the preparation of 4-acetoxyphenylmethyl carbinol. Angemeldet am 10. Juni 1993, veröffentlicht am 28. Dezember 1993, Anmelder: Hoechst Celanese Corp., Erfinder: B.N. Shah, D.Q. Tran, D.L. Keene.
- ↑ B.B. Corson, W.J. Heintzelman, L.H. Schwartzman, H.E. Tiefenthal, R.J. Lokken, J.E. Nickels, G.R. Atwood, F.J. Pavlik: Preparation of vinylphenols and isopropenylphenols. In: J. Org. Chem. Band 23, Nr. 4, 1958, S. 544–549, doi:10.1021/jo01098a012.
- ↑ Ruben Vardanyan, Victor Hruby: Synthesis of Best-Seller Drugs. Elsevier Inc., Amsterdam, NL 2016, ISBN 978-0-12-411492-0, S. 360.
- ↑ Patent US3966813: Process for the preparation of 1-(m- and p-hydroxyphenyl)-2-aminoethanol. Angemeldet am 20. Juni 1972, veröffentlicht am 29. Juni 1976, Anmelder: Warner-Lambert Co., Erfinder: G. Satzinger, W.D. Herrmann.
- ↑ Patent US5175368: Process for the preparation of arylalkylamines and substituted arylalkylamines. Angemeldet am 29. Juni 1992, veröffentlicht am 29. Dezember 1992, Anmelder: Hoechst Celanese Corp., Erfinder: A.M. Tafesh, J.A. McDonough, G.N. Mott.
- ↑ F. von Bruchhausen, S. Ebel, A.W. Frahm, E. Hackenthal: Hagers Handbuch der Pharmazeutischen Praxis, Band 7, 5. Aufl. Springer-Verlag, Berlin 1993, ISBN 978-3-642-63429-1, S. 367.
- ↑ Einstufung von Synephrin-haltigen Produkten, Stellungnahme der Gemeinsamen Expertenkommission. Bundesamt für Verbraucherschutz und Lebensmittelsicherheit, 21. September 2021, abgerufen am 4. April 2022.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 4-Butoxyacetophenon: CAS-Nr.: 5736-89-0, EG-Nr.: 227-248-4, ECHA-InfoCard: 100.024.772, PubChem: 79814, ChemSpider: 72107, Wikidata: Q81991154.
- ↑ Patent US4524217: Process for producing N-acyl-hydroxy aromatic amines. Angemeldet am 8. Juni 1984, veröffentlicht am 18. Juni 1985, Anmelder: Celanese Corp., Erfinder: K.G. Davenport, C.B. Hilton.
