5-Amino-1-pentanol
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | |||||||||||||||||||
| Name | 5-Amino-1-pentanol | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H13NO | ||||||||||||||||||
| Kurzbeschreibung |
weiße bis blassgelbe Kristallklumpen[1] bzw. farblose erstarrte Masse oder Brocken[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 103,16 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Brechungsindex |
1,4618 (17 °C, 589 nm)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
5-Amino-1-pentanol ist ein 1,5-Aminoalkohol mit einer primären Aminogruppe und einer primären Hydroxygruppe an den Enden einer linearen C5-Alkankette. Als Derivat der aus Pentosen einfach zugänglichen Plattformchemikalie Furfural könnte 5-Amino-1-pentanol zukünftig größere Bedeutung erlangen als Baustein für bioabbaubare Polyesteramide und als Ausgangsstoff für Valerolactam – dem Monomer für Polyamid 5.
Vorkommen und Darstellung
[Bearbeiten | Quelltext bearbeiten]Bei der vollständigen katalytischen Hydrierung von Furfural (Furan-2-aldehyd) entsteht Tetrahydrofurfurylalkohol (2-Hydroxymethyltetrahydrofuran), der unter Ringerweiterung zu Dihydropyran dehydratisiert werden kann. Dihydropyran reagiert mit Ammoniak in einer reduktiven Aminierung unter Ringöffnung zu 5-Amino-1-pentanol.[4]

Bei kontinuierlicher Prozessführung an einem Nickel-Hydrotalcit-Kontakt können Produktausbeuten bis 85 % erzielt werden.
In ähnlicher Weise kann das aus Dihydropyran mit Salzsäure praktisch quantitativ gebildete Hemiacetal 2-Hydroxytetrahydropyran[5] durch reduktive Amidierung mit Ammoniak und Wasserstoff unter Wasserabspaltung zu 5-Amino-1-pentanol umgesetzt werden.[6]

Eigenschaften
[Bearbeiten | Quelltext bearbeiten]5-Amino-1-pentanol bildet bei Erstarrungstemperaturen um 35 °C weiße Kristallklumpen, die sich in Wasser, Ethanol und Aceton lösen.[3] Die wässrige Lösung (500 g·l−1) reagiert stark alkalisch (pH-Wert 13.2 bei 20 °C).[2]
Anwendungen
[Bearbeiten | Quelltext bearbeiten]Aminoalkohole wie 5-Amino-1-pentanol wurden auf ihre Eignung zur Absorption von Kohlendioxid aus Verbrennungsgasen[7] oder durch Bindung in Beton[8] untersucht.
Beim Erhitzen auf 400 °C über Ytterbium(III)-oxid Yb2O3 entsteht mit hoher Selektivität durch Wasserabspaltung 4-Penten-1-amin (I)[9] neben geringen Mengen von Piperidin (II), 2,3,4,5-Tetrahydropyridin (III) und 1-Pentylamin (IV).[10]
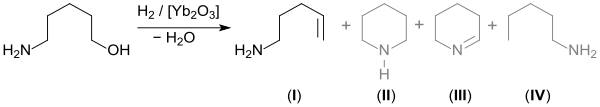
Auch die Bildung von 5-Hydroxypentanal und 1-Methylpiperidin aus 5-Amino-1-pentanol ist beschrieben.
Aus dem bifunktionellen 5-Amino-1-pentanol können durch Polykondensation mit Estern von Dicarbonsäuren bzw. deren cyclischen Säureanhydriden, wie z. B. Bernsteinsäureanhydrid, Polyesteramide erhalten werden, die als biologisch abbaubare Kunststoffe, z. B. resorbierbare Nahtmaterialien[11], untersucht wurden.[12]
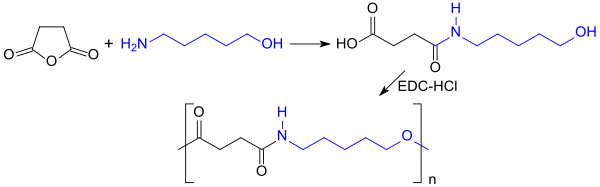
Zunächst reagiert das Bernsteinsäureanhydrid mit der nucleophileren Aminogruppe zu einer ω-Hydroxycarbonsäure, die anschließend mit wasserabspaltenden Carbodiimiden, wie z. B. dem Hydrochlorid des 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimids (EDC·HCl), polykondensiert wird.
In einer durch Rhodium(I)-Komplexe katalysierten dehydrierenden Kupplung entsteht aus 5-Amino-1-pentanol Valerolactam, das δ-Lactam der 5-Aminopentansäure, mit hoher (94 %) Ausbeute.[13]

Der oxidative Ringschluss von 5-Amino-1-pentanol zum Lactam 2-Piperidon gelingt auch mit dem Wasserstoff-Transfer-Katalysator Trirutheniumdodecacarbonyl Ru3(CO)12 im Verbund mit einem Phosphankomplex.[14]
Die gute Verfügbarkeit von Valerolactam als direktem Folgeprodukt des 5-Amino-1-pentanols, das wiederum aus nachwachsenden Rohstoffen einfach und effizient zugänglich ist, könnte für das bisher wenig beachtete, aber u. a. wegen seiner ferroelektrischen Eigenschaften interessante Polyamid 5[15] neue Perspektiven eröffnen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b Eintrag zu 5-Amino-1-pentanol bei TCI Europe, abgerufen am 12. April 2022.
- ↑ a b c d e f g Datenblatt 5-Amino-1-pentanol bei Sigma-Aldrich, abgerufen am 12. April 2022 (PDF).
- ↑ a b c d e William M. Haynes: CRC Handbook of Chemistry and Physics, 97th Edition. CRC Press, Boca Raton, FL, U.S.A. 2017, ISBN 978-1-4987-5429-3, S. 3–22.
- ↑ X. Li, J. Tian, H. Liu, X. Hu, J. Zhang, C. Xia, J. Chen, H. Liu, Z. Huang: Efficient Synthesis of 5-Amino-1-pentanol from Biomass-Derived Dihydropyran over Hydrotalcite-Based Ni–Mg3AlOx Catalysts. In: ACS Sustainable Chem. Eng. Band 8, Nr. 23, 2020, S. 6352–6362, doi:10.1021/acssuschemeng.0c00394.
- ↑ T. Oishi, M. Kanemoto, R. Swasono, N. Matsumori, M. Murata: Combinatorial Synthesis of the 1,5-Polyol System Based on Cross Metathesis: Structure Revision of Amphidinol 3. In: Org. Lett. Band 10, Nr. 22, 2008, S. 5203–5206, doi:10.1021/ol802168r.
- ↑ J. Zhang et al.: Reductive amination of bio-based 2-hydroxytetrahydropyran to 5-amino-1-pentanol over nano-Ni-Al2O3 catalysts. In: New J. Chem. Band 45, Nr. 9, 2021, S. 4236–4245, doi:10.1039/D0NJ04962J.
- ↑ P. Singh, G.F. Versteeg: Structure and activity relationships for CO2 regeneration from aqueous amine-based absorbents. In: Process Saf. Environ. Prot. Band 86, Nr. 5, 2008, S. 347–359, doi:10.1016/j.psep.2008.03.005.
- ↑ S. Oa, B.-J. Kim, J.-W. Park: Effects of carbonation on carbon dioxide capture and the mechanical properties of concrete with amine sorbents. In: Adv. Cement Res. Band 32, Nr. 11, 2020, S. 502–509, doi:10.1680/jadrcr.18.00198.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 4-Penten-1-amin: CAS-Nr.: 22537-07-1, EG-Nr.: 800-972-3, ECHA-InfoCard: 100.227.544, PubChem: 533854, ChemSpider: 465122, Wikidata: Q72500048.
- ↑ K. Ohta, Y. Yamada, S. Sato: Dehydration of 5-amino-1-pentanol over rare earth oxides. In: Appl. Catal A: General. Band 517, 2016, S. 73–80, doi:10.1016/j.apcata.2016.03.001.
- ↑ Patent US4209607: Polyesteramides derived from bis-oxamidodiols and dicarboxylic acids. Angemeldet am 12. Mai 1978, veröffentlicht am 24. Juni 1980, Anmelder: Ethicon, Inc., Erfinder: S.W. Shalaby, D.D. Jamiolkowski.
- ↑ S.K. Murase, J. Puiggali: Natural and Synthetic Biomedical Polymers, Chapter 8: Poly(ester amides)s: Recent Developments on Synthesis and Applications. Hrsg.: S.G. Kumbar, C.T. Laurencin, M. Deng. Elsevier, Inc., Amsterdam 2014, ISBN 978-0-12-396983-5, S. 154–166.
- ↑ M. Trincado, K. Kühlein, H. Grützmacher: Metal-ligand cooperation in the catalytic dehydrogenative coupling (DHC) of polyalcohols to carboxylic acid derivatives. In: Chem. Eur. J. Band 17, Nr. 42, 2011, S. 11905–11913, doi:10.1002/chem.201101084.
- ↑ D. Pingen, D. Vogt: Amino-alcohol cyclization: selektivem synthesis of lactams and cyclic amines from amino-alcohols. In: Catal. Sci. Technol. Band 4, 2014, S. 47–52, doi:10.1039/C3CY00513E.
- ↑ T. von Tiedemann, S. Anwas, U. Kemmer-Jonas, K. Asadi, H. Frey: Synthesis and solution processing of nylon-5 ferroelectric thin films: The renaissance of odd-nylons? In: Macromol. Chem. Phys. Band 221, Nr. 5, 2020, S. 1900468, doi:10.1002/macp.201900468.

