Acrylsäureethylester
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
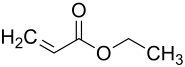
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Acrylsäureethylester | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C5H8O2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 100,12 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
0,92 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
100 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
schlecht in Wasser (20 g·l−1 bei 25 °C)[1] | |||||||||||||||
| Brechungsindex |
1,406 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| MAK | ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Acrylsäureethylester, häufig auch Ethylacrylat genannt, ist eine organische chemische Verbindung aus der Gruppe der Carbonsäureester (genauer der Acrylsäureester). Sie liegt in Form einer leichtentzündlichen und flüchtigen Flüssigkeit mit unangenehm stechendem Geruch vor.
Geschichte
[Bearbeiten | Quelltext bearbeiten]Acrylsäureethylester wird seit den frühen 1930er Jahren kommerziell hergestellt.[7] Ethylacrylat ist inzwischen mit einer Jahresproduktionsmenge von ca. 500.000 Tonnen nach Acrylsäurebutylester der weltweit wichtigste Acrylsäureester. So wurden im Jahr 2006 in den USA 262 Kilotonnen (kt), in Westeuropa 63 kt, in Südafrika 35 kt und in Südkorea 50 kt[8] sowie im Jahr 2009 in China 94 kt Acrylsäureethylester produziert.[9]
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Acrylsäureethylester kann durch mehrere Verfahren hergestellt werden. So kann es durch Reaktion von Acrylnitril mit Ethanol und Schwefelsäure als Katalysator gewonnen werden. Es kann weiterhin aus Acetylen, Kohlenmonoxid und Ethanol gewonnen werden. Nach einem Verfahren der Celanese Corp. wurde in USA Ethylacrylat auch durch Umsetzung von Acrylsäure mit Ethylen und Schwefelsäure über die intermediär entstehenden Schwefelsäureester Ethylsulfat bzw. Diethylsulfat hergestellt.[10]
In einer Pilotanlage der ADM Corp. wird die katalytische Umwandlung von Biomasse (Maisstengel) in der Reaktionssequenz Glucose → Glycerin → Acrolein → Acrylsäure + Ethanol → Acrylsäureethylester untersucht.[11]
Industriell wird Ethylacrylat durch direkte Veresterung von Acrylsäure mit Ethanol hergestellt. Als Katalysatoren eignen sich Schwefelsäure, para-Toluolsulfonsäure oder saure Ionentauscher-Harze, wobei letztere bevorzugt verwendet werden.[12]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Acrylsäureethylester ist chemisch instabil und neigt unter dem Einfluss von Licht, bei erhöhter Temperatur und bei Kontakt mit Peroxiden auch in stabilisierter Form zur spontanen (z. T. explosiven) Polymerisation. Die Polymerisationswärme beträgt −78 kJ·mol−1 bzw. −779 kJ·kg−1.[13] Es besitzt eine Viskosität von 0,55 mPa·s bei 25 °C und eine spezifische Wärmekapazität von 1,98 kJ/(kg·K). Wegen der hohen Polymerisationsneigung wird Ethylacrylat handelsüblich mit 15±5 ppm MEHQ stabilisiert. Bei Lagerung unter Lichtausschluss in Anwesenheit von polymerisationsinhibierend wirkendem Sauerstoff und bei Temperaturen unter 35 °C ist jedoch eine Lagerdauer von einem Jahr gegeben.[14]
Sicherheitstechnische Kenngrößen
[Bearbeiten | Quelltext bearbeiten]Acrylsäureethylester bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 9 °C.[1][15] Der Explosionsbereich liegt zwischen 1,7 Volumenprozent (69 g/m³) als untere Explosionsgrenze (UEG) und 13 Volumenprozent (540 g/m³) als obere Explosionsgrenze (OEG).[1][15] Hier ergibt sich ein oberer Explosionspunkt von 6 °C.[1] Der maximale Explosionsdruck beträgt 8,9 bar.[1][15] Die Grenzspaltweite wurde mit 0,86 mm bestimmt.[1][15] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB.[15] Die Zündtemperatur beträgt 350 °C.[1][15] Der Stoff fällt somit in die Temperaturklasse T2.
Verwendung
[Bearbeiten | Quelltext bearbeiten]Addition an Amine
[Bearbeiten | Quelltext bearbeiten]Acrylsäureethylester reagiert unter Katalyse durch Lewis-Säuren in einer Michael-Addition mit Aminen in hohen Ausbeuten zu β-Alanin-Derivaten[16]
Die nucleophile Addition an Acrylsäureethylester als α,β-ungesättigte Carbonylverbindung ist das wiederkehrende Motiv bei der Synthese von pharmazeutischen Zwischenprodukten, die zu (inzwischen obsoleten) Wirkstoffen wie dem Hypnotikum Glutethimid oder dem Vasodilatator Vincamin[17] oder neueren Therapeutika wie dem COPD-Wirkstoff Cilomilast oder dem Nootropikum Leteprinim führen.[18]
Diels-Alder-Reaktionen
[Bearbeiten | Quelltext bearbeiten]Mit Dienen geht Ethylacrylat als Dienophil Diels-Alder-Reaktionen ein, die z. B. mit 1,3-Butadien in einer [4+2]-Cycloaddition mit hoher Ausbeute zu einem 3-Cyclohexencarbonsäureethylester reagieren.[19]
Umesterung zu anderen Acrylsäureestern
[Bearbeiten | Quelltext bearbeiten]Acrylsäureethylester ist Edukt für homologe Acrylsäureester (Alkylacrylate) durch Umesterung mit höheren Alkoholen mittels saurer oder basischer Katalyse. So werden Spezialacrylate zugänglich, wie z. B. das für druckempfindliche Klebstoffe verwendete 2-Ethylhexylacrylat (aus 2-Ethylhexanol), das für Automobilklarlacke verwendete Cyclohexylacrylat (aus Cyclohexanol), das z. B. mit Diisocyanaten zu quellbaren Gelen vernetzbare 2-Hydroxyethylacrylat (aus Ethylenglycol), die als Comonomer für Kammpolymere, die den Erstarrungspunkt von Paraffinölen herabsetzen, brauchbaren langkettigen Acrylate (aus C18+-Alkoholen)[20] sowie das zur Herstellung von Flockungsmitteln für die Abwasserklärung und Papierherstellung wichtige 2-Dimethylaminoethylacrylat (aus Dimethylaminoethanol[21]).
Polymere
[Bearbeiten | Quelltext bearbeiten]Als reaktives Monomer findet Ethylacrylat Verwendung in Homopolymeren und Copolymeren mit u. a. Ethylen, Acrylsäure und seinen Salzen, Amiden und Estern, Methacrylaten, Acrylnitril, Maleinsäureestern, Vinylacetat, Vinylchlorid, Vinylidenchlorid, Styrol, Butadien und ungesättigten Polyestern.[22]
Copolymere von Acrylsäureethylester mit Ethylen (englisch EEA / ethylene-ethyl acrylate copolymers) eignen sich wie Ethylen-Vinylacetat-Copolymere als Klebstoffe und Polymeradditive,[23] Copolymere mit Acrylsäure erhöhen die Reinigungswirkung von flüssigen Waschmitteln,[24] Copolymere mit Methacrylsäure werden als magensaftresistente Tablettenüberzüge (Eudragit®) eingesetzt.[25]
Die große Zahl möglicher Comonomer-Einheiten und deren Kombination in Co- und Terpolymeren mit Ethylacrylat erlaubt die Realisierung unterschiedlicher Eigenschaften der Acrylat-Copolymere in einer Vielzahl von Anwendungen von Anstrichfarben und Klebstoffen über Papier-, Textil- und Lederhilfsmittel zu Kosmetik- und Pharmaprodukten.
Aromastoff
[Bearbeiten | Quelltext bearbeiten]Acrylsäureethylester wird auch als Aromastoff verwendet. Es wurde als flüchtiger Bestandteil in Ananas und Beaufort-Käse[7] gefunden und ist eine Nebenkomponente im Vanille-Aroma, die bei der Heißextraktion von Vanille in Mengen bis über 1 ppm anfällt und in derart hohen Konzentrationen das Extraktaroma negativ beeinflusst.[26] In der EU ist die Verbindung unter der FL-Nummer 09.037 als Aromastoff für Lebensmittel zugelassen.[27]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]Bei Kontakt mit Ethylacrylat besteht die Gefahr der Sensibilisierung der Haut. Hinweise aus Tierversuchen auf eine mögliche Kanzerogenität von Acrylsäureethylester[28] sind nicht übertragbar auf Menschen.[29] Die hohe Giftigkeit von Ethylacrylat (LD50 400 mg/kg Ratte oral[6] und LD50 1800 mg/kg Kaninchen dermal[28]) macht die Handhabung des Stoffs in geschlossenen Kompartimenten erforderlich. Der stechende Geruch des Ethylacrylats ist jedoch schon bei Konzentrationen von ca. 1 ppb wahrnehmbar,[30] die weit unter dem Richtwert für die akute Exposition (Acute Exposure Guideline Level / AEGL-1) der EPA von 8,3 ppm liegen.[31]
Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c d e f g h i j k l m n o p q r Eintrag zu Ethylacrylat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 12. Juni 2017. (JavaScript erforderlich)
- ↑ Datenblatt Ethyl acrylate, ≥99.5%, stabilized, FG bei Sigma-Aldrich, abgerufen am 4. Mai 2016 (PDF).
- ↑ Eintrag zu Ethyl acrylate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 140-88-5 bzw. Ethylacrylat), abgerufen am 16. September 2019.
- ↑ Grenzwerte für Arbeitsstoffe ( vom 23. September 2015 im Internet Archive) Verordnung des Bundesministers für Arbeit, Soziales und Konsumentenschutz (Grenzwerteverordnung GKV 2011), Österreich
- ↑ a b U.S. Department of Labor: Ethyl Acrylate ( vom 28. Mai 2010 im Internet Archive)
- ↑ a b IARC Working Group on the Evaluation of Carcinogenic Risks to Humans (Hrsg.): Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide (= IARC monographs on the evaluation of carcinogenic risks to humans. Band 71). World Health Organization, International Agency for Research on Cancer, Lyon 1999, ISBN 978-92-832-1271-3 (iarc.fr).
- ↑ CEH Marketing Research Report Acrylic Acid and Esters, SRI Consulting, July 2007
- ↑ China Chemical Reporter, November 6, 2010, Competition in the acrylic industry is becoming fiercer ( vom 22. Februar 2016 im Internet Archive).
- ↑ Patent US4507495: Process for production of ethyl acrylate. Veröffentlicht am 26. März 1985, Anmelder: Celanese Corp., Erfinder: Edward F. Dougherty, Mark O. Scates, James L. Paul.
- ↑ T.P. Binder, Conversion of Lignocellulosic Biomass to Ethanol and Ethyl Acrylate, Biomass Program IBR Platform Peer Review, 3. Februar 2011
- ↑ Ullmann's Encyclopedia of Industrial Chemistry. 1. Auflage. Wiley, 2000, ISBN 978-3-527-30385-4, Acrylic Acid and Derivatives, doi:10.1002/14356007.a01_161.pub4.
- ↑ Brandrup, J.; Immergut, E.H.; Grulke, E.A.; Abe, A.; Bloch, D.R.: Polymer Handbook, 4th Edition, Wiley-VCH 2003, ISBN 978-0-471-47936-9, S. II/368.
- ↑ BASF AG: Technical Data Sheet, Ethyl acrylate, August 2003, abgerufen am 4. Mai 2016
- ↑ a b c d e f E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ Jose Cabral, Pierre Laszlo, Loïc Mahé, Marie-Thérèse Montaufier, S. Lalatiana Randriamahefa: Catalysis of the specific Michael addition: The example of acrylate acceptors. In: Tetrahedron Letters. Band 30, Nr. 30, 1989, S. 3969–3972, doi:10.1016/S0040-4039(00)99297-9.
- ↑ Pharmazeutische Wirkstoffe: Synthesen, Patente, Anwendungen; von A. Kleemann u. J. Engel; 2., neubearb. u. erw. Aufl.; Stuttgart, New York; Thieme; 1982, ISBN 3-13-558402-X
- ↑ D. Lednicer, The Organic Chemistry of Drug Synthesis, Volume 7, J. Wiley & Sons, 2008, ISBN 978-0-470-10750-8
- ↑ K.P.C. Vollhardt, N.E. Schore, Organische Chemie, 5. Aufl., Wiley-VCH, 2012, ISBN 978-3-527-33250-2
- ↑ Patent WO1999031042: Method for conditioning long chain alkyl acrylates. Angemeldet am 10. Dezember 1998, veröffentlicht am 24. Juni 1995, Anmelder: Elf Atochem S.A., Erfinder: J.-M. Paul, J.-P. Gamet.
- ↑ Patent EP1284954: Verfahren zur herstellung von estern ungesättigter carbonsäuren. Veröffentlicht am 4. August 2004, Anmelder: BASF Aktiengesellschaft, Erfinder: Gerhard Nestler, Jürgen Schröder.
- ↑ Technical Data Sheet – Ethyl Acrylate. (PDF) In: dow.com. Archiviert vom (nicht mehr online verfügbar) am 18. Juli 2012; abgerufen am 20. Februar 2013 (englisch).
- ↑ DuPontTM Elvaloy® AC Products and Properties. In: dupont.com. Archiviert vom (nicht mehr online verfügbar) am 13. März 2013; abgerufen am 20. Februar 2013 (englisch).
- ↑ Patent US5409629: Use of acrylic acid/ethyl acrylate copolymers for enhanced clay soil removal in liquid laundry detergents. Veröffentlicht am 25. April 1995, Anmelder: Rohm and Haas Company, Erfinder: Jan E. Shulman, Charles E. Jones.
- ↑ EUDRAGIT® L 100-55 – EUDRAGIT® – Targeted Drug Release and Tailored Service. In: evonik.com. Archiviert vom (nicht mehr online verfügbar) am 12. August 2013; abgerufen am 20. Februar 2013 (englisch).
- ↑ Sensory-Directed Flavor Analysis, Ray Marsili edit., CRC Press, Taylor & Francis Group, Boca Raton, 2007, ISBN 1-57444-568-5
- ↑ Food and Feed Information Portal Database | FIP. Abgerufen am 1. September 2024.
- ↑ a b SCOEL/SUM/47, October 2004
- ↑ Basic Acrylic Monomer Manufacturers, Inc., The European Union Consumer Products Safety & Quality Unit Does Not Recognize Ethyl Acrylate as a Possible Human Carcinogen, Last Updated: 4/3/12
- ↑ ETHYL ACRYLATE. epa.gov, abgerufen am 20. Februar 2013 (englisch).
- ↑ Ethyl acrylate Results. epa.gov, abgerufen am 20. Februar 2013 (englisch).
- Feuergefährlicher Stoff
- Beschränkter Stoff nach REACH-Anhang XVII, Eintrag 40
- Gesundheitsschädlicher Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Hautkontakt
- Giftiger Stoff bei Einatmen
- Hautreizender Stoff
- Sensibilisierender Stoff
- Augenreizender Stoff
- Atemwegsreizender Stoff
- Umweltgefährlicher Stoff (chronisch wassergefährdend)
- Acrylsäureester
- Aromastoff (EU)
- Futtermittelzusatzstoff (EU)
- Carbonsäureethylester




