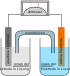
Aluminium-Akkumulator
Ein Aluminiumionen-Akkumulator, ist ein Akkumulator-Typ, welcher auf Aluminiumverbindungen basiert. Aluminium-Akkumulatoren sind, in verschiedenen Variationen, seit den 1980er Jahren Ziel verschiedener Forschungsprojekte. So wurden im Jahr 2015 an der Stanford University Verbesserungen wie vergleichsweise geringe Ladezeiten gemeldet, praktische Aufbauten beschränken sich bei diesen Akkumulatoren auf einzelne Prototypen.[1] Selbst bei starker Beschädigung im Einsatz entzündete sich der Akku bei Tests nicht.[2] Die Elektrolyten sind aber feuchtigkeitsempfindlich. Im Jahr 2022 wurde am MIT eine Batteriearchitektur präsentiert, bei der Aluminium und Schwefel als Elektrodenmaterialien mit einem geschmolzenen Salz als Elektrolyt dazwischen verwendet werden.[3]
Durch den Ersatz von Lithium durch Aluminium an der negativen Elektrode ergibt sich zwar eine geringere elektrische Zellspannung von 2,65 V als im Vergleich zu Lithiumionenakkumulatoren mit ca. 3,7 V. Dafür ist die theoretische mögliche Energiedichte mit bis zu 1 kWh/kg deutlich höher als im Vergleich zu Lithiumionenakkumulatoren mit einer Grenze um die 400 Wh/kg.[4] Die Differenz ergibt sich aus dem Umstand, dass Aluminium drei Valenzelektronen aufweist, während Lithium nur ein Valenzelektron besitzt.
Zu den praktischen Schwierigkeiten bei Aluminium-Ionen-Akkumulatoren zählt die geringe Lagerfähigkeit und dass die konkrete Kapazität von der Betriebstemperatur und der Ladezyklenanzahl abhängt.[5] Die Forschungsbemühungen der letzten 30 Jahre sind jedoch auf zahlreiche Probleme gestoßen, z. B. Zersetzung des Kathodenmaterials im Fall oxidischer Wirtsmaterialien (z. B. Vanadium(V)-oxid[6] oder Mangan(IV)-oxid[7]), niedrige Entladespannung, kapazitives Verhalten ohne Plateaus bei der Entladespannung und – bei oxidischen Kathodenmaterialien – unzureichende Zyklenlebensdauer (weniger als 100 Zyklen) mit schnellem Kapazitätsabfall.[1] Für neuere Entwicklungen (Januar 2023) mit Grafitpulver auf der Kathodenseite wird jedoch eine Zyklenstabilität von durchschnittlich 255.000 angegeben, mit einem Rekord von 500.000.[8] Auch die Lade- und Entladezeiten stellen mit 36 Sekunden (100C) einen Rekord dar.
Am 22. Mai 2023 veröffentlichten Forschungsgruppen der Universitäten Freiburg und Ulm die Ergebnisse einer Untersuchung für den Einsatz eines so genannten Redox-Polymers mit der Bezeichnung Poly(3-vinyl-N-Methylphenothiazin) als Kathodenmaterial in Aluminium-Ionen-Akkumulatoren. Als Elektrolyt wurde die ionische Flüssigkeit Ethylmethylimidazoliumchlorid verwendet. Als Ladungsträger bzw. Anionen fungieren wie beim Aluminium-Chlorid-Grafit-Akkumulator die Verbindungen AlCl4– und Al2Cl7– welche mit einem Potenzial von 0,81 V bzw. 1,65 V in der Kathode eingelagert werden. Die spezifische Kapazität der Kathode beträgt laut den Forschern 167 Milliamperestunden pro Gramm (mAh/g), wobei das theoretische Maximum bei 221 mAh/g liegt. Im Vergleich dazu erzielten die bisher verwendeten Kathoden aus Grafit eine Entladekapazität von 120 mAh/g. Die neue Kathode lieferte nach 5000 Zyklen bei einer Lade-Entladerate von 10C (volle Be- und Entladung in jeweils sechs Minuten) noch eine Kapazität von über 88 %.[9][10]
Aluminium-Chlorid-Grafit-Akkumulator
[Bearbeiten | Quelltext bearbeiten]An den Elektroden laufen beim Laden des Akkumulators die folgende chemische Reaktion von links nach rechts ab. Bei der Entladung läuft der reversible chemische Prozess ab. In der Literatur wurden die vereinfachten Al/Grafit-Zellen-Redoxreaktionen während Ladung und Entladung wie folgt beschrieben:[1][8][11]
Anode:
Kathode:
In diesem Fall wird Grafit als Kathodenmaterial eingesetzt. Dabei ist n in das molare Verhältnis der Kohlenstoffatome zu den eingelagerten Anionen im Grafit. Zur Maximierung der Oberfläche wird in den Experimentalaufbauten bei der Kathode feines Grafitpulver verwendet. Die Anode besteht aus einer Aluminiumfolie ohne besondere Reinheitsanforderungen. Als Elektrolyt eignen sich ionische Lösungsmittel (z. B. Ethylmethylimidazoliumchlorid) oder Lösungsmittel mit niedrigem eutektischen Punkt, basierend auf AlCl3. Zu letzteren gehören AlCl3-Mischungen mit Amiden wie Harnstoff oder Acetamid, oder mit Triethylammoniumchlorid. Es werden hohe Leistungsdichten, sehr kurze Lade- und Entlade-Zeiten (36 Sekunden, entsprechend 100C) und hohe Lebensdauern (> 250.000 Lade-Entlade-Zyklen) berichtet.[8] Für eine breite technische Anwendung muss jedoch noch die Korrosionsfestigkeit von Gehäuse und Membran verbessert (oder ein weniger korrosiver Elektrolyt gefunden) werden und die Labormodelle auf größeren Maßstab übertragen werden.[8]
Aluminium-Ionen-Akkumulator
[Bearbeiten | Quelltext bearbeiten]Er ist im Aufbau ähnlich wie der Lithium-Ionen-Akkumulator, an der negativen Elektrode wird dabei aber das Leichtmetall Aluminium statt Lithium eingesetzt.
In der Literatur wird der Begriff „Aluminium-Ionen-Akkumulator“ für eine Vielzahl von Systemen (wie bspw. Aluminium-Chlorid-Grafit-Akkumulator) verwendet, die Aluminium verwenden. In der Literatur wurde vorgeschlagen, dass ein „Aluminium-Ionen-Akkumulator“ durch einen unidirektionalen Fluss von Al3+-Ionen von einer Elektrode zur anderen gekennzeichnet ist.[12] Die meisten Studien beziehen sich jedoch auf Aluminium-Chlorid-Grafit-Akkumulatoren und nicht auf Aluminium-Ionen-Akkumulator, da AlCl4– anstelle von Al3+ die mobile Spezies ist.[12]
Weblinks
[Bearbeiten | Quelltext bearbeiten]- Cordis Webseite zum Alion-Projekt
- ALION-Projekt – Europäisches Forschungsprojekt zu Al-Ionen-Akkus ( vom 15. August 2020 im Webarchiv archive.today)
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ a b c Meng-Chang Lin et al.: An ultrafast rechargeable aluminium-ion battery. In: Nature. Band 520, Nr. 7547. Macmillan Publishers Limited, 2015, S. 324–328, doi:10.1038/nature14340.
- ↑ Alu-Akkus: Der Traum aller Smartphone-User. Auf: wissenschaft.de vom 10. Juli 2015.
- ↑ Quanquan Pang, Jiashen Meng, Saransh Gupta, Xufeng Hong, Chun Yuen Kwok, Ji Zhao, Yingxia Jin, Like Xu, Ozlem Karahan, Ziqi Wang, Spencer Toll, Liqiang Mai, Linda F. Nazar, Mahalingam Balasubramanian, Badri Narayanan, Donald R. Sadoway: Fast-charging aluminium–chalcogen batteries resistant to dendritic shorting. In: Nature. Band 608, Nr. 7924, August 2022, S. 704–711, doi:10.1038/s41586-022-04983-9.
- ↑ Oak Ridge National Laboratory: Aluminum-Ion Battery to Transform 21st Century Energy Storage. In: web.ornl.gov. Oak Ridge National Laboratory, archiviert vom am 19. November 2015; abgerufen am 30. Oktober 2014 (englisch).
- ↑ John Hewitt: DoE calls for a chemical battery with 5x capacity, within 5 years – can it be done? In: http://www.extremetech.com/. Extreme Tech, abgerufen am 30. Oktober 2014 (englisch).
- ↑ N. Jayaprakash, S. K. Das, L. A. Archer: The rechargeable aluminum-ion battery. In: Chemical Communications. Band 47, Nr. 47, 2011, S. 12610, doi:10.1039/C1CC15779E.
- ↑ Leland Teschler: Goodbye to lithium-ion batteries? In: MachineDesign.com. 22. März 2012, abgerufen am 16. Juni 2016.
- ↑ a b c d Ulrike Wunderwald, Peter von Czarnecki, Martin Eckert, Charan Mukundan, Gero Frisch, Jean‐François Drillet, Felix Fuhrmann, Franziska Jach: Energiespeicher: Aluminium statt Lithium. In: Nachrichten aus der Chemie. Band 71, Nr. 1, Januar 2023, S. 38–41, doi:10.1002/nadc.20234124933.
- ↑ Mit organischem Redox-Polymer die Kapazität von Aluminium-Ionen-Batterien verbessern. 8. Juni 2023, abgerufen am 8. Juni 2023 (deutsch).
- ↑ Gauthier Studer, Alexei Schmidt, Jan Büttner, Maximilian Schmidt, Anna Fischer, Ingo Krossing, Birgit Esser: On a high-capacity aluminium battery with a two-electron phenothiazine redox polymer as positive electrode. In: Energy & Environmental Science. 22. Mai 2023, doi:10.1039/D3EE00235G.
- ↑ Kostiantyn V. Kravchyk, Shutao Wang, Laura Piveteau, Maksym V. Kovalenko: Efficient Aluminum Chloride–Natural Graphite Battery. In: Chemistry of Materials. Band 29, Nr. 10, 23. Mai 2017, S. 4484–4492, doi:10.1021/acs.chemmater.7b01060.
- ↑ a b Tilmann Leisegang, Falk Meutzner, Matthias Zschornak, Wolfram Münchgesang, Robert Schmid, Tina Nestler, Roman A. Eremin, Artem A. Kabanov, Vladislav A. Blatov, Dirk C. Meyer: The Aluminum-Ion Battery: A Sustainable and Seminal Concept? In: Frontiers in Chemistry. Band 7, 2019, doi:10.3389/fchem.2019.00268, PMID 31119122.

![{\displaystyle {\ce {AlCl4^- + C_{n}<=> C_{n}[AlCl4] + e-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f4c4a8bc397cb28a9d00b0dfe41a4704b39a13b)