Aluminiumoxid
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
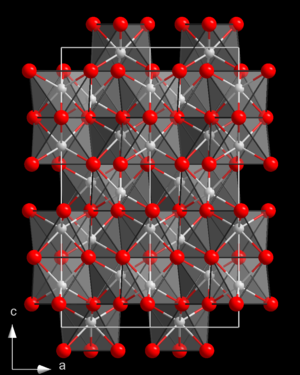
| Korund-Struktur _ Al3+ _ O2− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Aluminiumoxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | Al2O3 | |||||||||||||||||||||
| Kurzbeschreibung |
weißer, geruchloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 101,96 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
2980 ± 60 °C[2] | |||||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser, schwer löslich in Säuren und Basen[2] | |||||||||||||||||||||
| Brechungsindex |
1,77 (Saphir @500 nm)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
| |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 |
−1676 kJ·mol−1[6] | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||

Aluminiumoxid ist die Sauerstoffverbindung des chemischen Elements Aluminium. Im technischen Bereich wird Aluminiumoxid als Elektrokorund (ELK) bezeichnet.
Gewinnung und Darstellung
[Bearbeiten | Quelltext bearbeiten]Der wichtigste Rohstoff für die Aluminiumgewinnung ist Bauxit, ein Gemisch verschiedener Aluminium- und Eisenoxide und Hydroxide, die bei der lateritischen Verwitterung aluminiumhaltiger Minerale, vor allem Feldspäte, silikatischer Gesteine gebildet werden. Mit dem Bayer-Verfahren werden die Aluminiumhydroxide in heißer Natronlauge gelöst und von den unlöslichen Bestandteilen des Bauxits abgetrennt.[7] Zurück bleibt Rotschlamm, der ätzende Natronlauge und giftige Schwermetalle enthält und weltweit teilweise in offenen Deponien gelagert oder in Flüsse abgeleitet wird.
Beim Abkühlen und Verdünnen der Lösung und Zugabe von Gibbsit als Kristallisationskeim fällt das gelöste Aluminiumhydroxid aus. Das so gereinigte Aluminiumhydroxid (Gibbsit) wird getrocknet und kalziniert. Hierbei bildet sich über verschiedene, metastabile Zwischenprodukte (siehe Modifikationen) ab rund 1000 °C α-Al2O3 (Korund). Über die Kontrolle von Temperatur, Heizgeschwindigkeit und Korngrößen können strukturell unterschiedliche Aluminiumoxide hergestellt werden, die für unterschiedliche technische Anwendungen interessant sind.[7]
Die Darstellung von Aluminiumoxid kann auch durch vorsichtiges Dehydrieren von Gibbsit (Hydrargillit) oder Böhmit erfolgen.
Aluminiumoxid entsteht zudem bei der Verbrennung von Aluminiumpulver mit Ammoniumperchlorat in Feststoffraketen (vgl. Ammoniumperchlorat-Verbundtreibstoff).
Das reine Metall Aluminium weist nach Lagerung an Luft eine dünne spontane Aluminiumoxidschicht (Selbstpassivierung) auf, die es vor Korrosion schützt. Mittels einer elektrolytisch aufgebrachten Aluminiumoxidschicht werden durch Eloxieren die Aluminiumoberflächen von Gebrauchsgegenständen mit einer extrem harten (etwa Mohs-Härte 9) und korrosionsbeständigen Schutzschicht versehen. Zur Fertigung von Elektrolytkondensatoren verwendet man diese eloxierten Aluminiumsorten.
Die weltweite Produktion von Aluminiumoxid stieg von 108 Mio. t im Jahre 2014 auf geschätzte 118 Mio. t im Jahre 2015. Die drei größten Produzenten von Aluminiumoxid waren 2014 China (47,8 Mio. t), Australien (20,5 Mio. t) und Brasilien (10,6 Mio. t). Der USGS gibt als durchschnittliche US-Importpreise für Aluminiumoxid 410 USD je Tonne im Jahre 2015 an, während die Importpreise für Bauxit im selben Jahr bei 28 USD je Tonne lagen.[8]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Modifikationen
[Bearbeiten | Quelltext bearbeiten]Die Verbindung Al2O3 ist polymorph. Sie kristallisiert in unterschiedlichen Strukturen.[9][7]
| Name | Kristallsystem | Struktur |
|---|---|---|
| α-Al2O3 (Alpha-Tonerde) | rhomboedrisch / trigonal | Korundstruktur |
| γ-Al2O3 (Gamma-Tonerde) | kubisch | Spinellstruktur |
| δ-Al2O3 (Delta-Tonerde) | tetragonal | Spinellstruktur |
| χ-Al2O3 (Chi-Tonerde) | hexagonal | Schichtstruktur mit ungeordneter Schichtabfolge |
| κ-Al2O3 (Kapa-Tonerde) | hexagonal | Schichtstruktur mit geordneter Schichtabfolge |
| η-Al2O3 (Eta-Tonerde) | tetragonal | verzerrte Spinellstruktur, in einer Dimension ungeordnet |
| Θ-Al2O3 (Theta-Tonerde) | monoklin | verzerrte Spinellstruktur, analog β-Ga2O3 |
Streng genommen handelt es sich bei diesen Strukturvarianten nicht um richtige Modifikationen (Polymorphe) von Al2O3. Zum einen enthalten die bei tiefen Temperaturen gebildeten Formen noch etwas Hydroxidionen (OH). Vor allem aber ist die Abfolge der Phasenumwandlungen nicht umkehrbar. α-Al2O3 z. B. kann nicht wieder in Kapa-Al2O3 oder Theta-Al2O3 umgewandelt werden. Nur α-Al2O3 (Korund) ist thermodynamisch stabil. Die übrigen Zwischenprodukte sind thermodynamisch instabil, wohl aber reproduzierbare Schritte der strukturellen Umorganisation von Gibbsit zu Korund.[7]
Bislang (2024) sind nur zwei dieser Strukturvarianten aus der Natur bekannt:
- Korund: α-Al2O3
- Deltalumit: δ-Al2O3[10]
β-Tonerde ist kein reines Aluminiumoxid, sondern eine Natrium-Aluminium-Oxid-Verbindung mit der Zusammensetzung Na2Al22O34 (Na2O·11Al2O3). Diese Verbindung kommt auch natürlich vor und hat den Mineralnamen Diaoyudaoit.[11]
Elektrische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Al2O3 ist ein sehr guter Isolator und besitzt eine sehr hohe Durchschlagsfestigkeit von 35 kV/mm. Der spezifische Widerstand beträgt bei 20 °C 1012 Ω m, bei 1000 °C sinkt er auf 107 Ω·m. Die relative Permittivität beträgt 9–10 bei 100 MHz, der Verlustfaktor etwa 10−4.[12][13]
Thermische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Unter Standardbedingungen liegt die Wärmeleitfähigkeit aufgrund der Phononenresonanz bei einem für Keramikmaterialien vergleichsweise sehr hohen Wert von 35,6–39 W·m−1·K−1 (einkristalliner Korund: 40 W·m−1·K−1, dichte Keramik mit 96 % Al2O3 ca. 25 W·m−1·K−1), der mit sinkender Temperatur stark ansteigt und mit steigender Temperatur bei 1000 °C auf etwa 5 W·m−1·K−1 absinkt.[14]
Der Ausdehnungskoeffizient liegt im Bereich 6,5–8,9·10−6 K−1.[13]
Die Schmelztemperatur beträgt 2054 °C, daher sollte die Anwendungstemperatur hochreiner Aluminiumoxidkeramik unter 1900 °C liegen.
Chemische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Al2O3 ist ein amphoteres Salz, das heißt, es kann als Säure (in Verbindung mit einer Base) oder als Base (in Verbindung mit einer Säure) reagieren.
Das γ-Al2O3 ist ein hygroskopisches, weißes, lockeres Pulver, das nicht in Wasser, dafür in starken Säuren und Basen löslich ist. Bereits ab 800 °C geht das γ-Al2O3 in das in Säuren wie Basen im Allgemeinen unlösliche α-Al2O3 über.
γ-Al2O3 ist ein poröses Material, dessen Oberflächenstruktur stark von dem Herstellungsprozess, beziehungsweise dessen Temperatur, beeinflusst werden kann. In der Chromatographie wird es als stationäre Phase verwendet.
Mit verschiedenen Metalloxiden bildet Aluminiumoxid Aluminate.
Mechanische Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Die mechanischen Eigenschaften der Aluminiumoxidkeramik hängen von der Reinheit und dem Gefüge der hergestellten Keramik ab. Je reiner die Sorte ist, desto bessere Eigenschaften werden erzielt, desto aufwendiger wird aber auch der gesamte Herstellungsprozess. Neben den in der Tabelle unten aufgeführten Eigenschaften[15] zeichnet sich Aluminiumoxidkeramik auch durch sehr gute tribologische Eigenschaften bzw. ein sehr gutes Reibungs- und Verschleißverhalten aus:
| Eigenschaft | 96 % | 99,8 % |
|---|---|---|
| Dichte | 3,75 g/cm³ | 3,96 g/cm³ |
| Biegefestigkeit | 310 MPa | 630 MPa |
| Weibullmodul | 13 | 15 |
| Druckfestigkeit | 2500 MPa | 4000 MPa |
| Bruchzähigkeit | 4,0 MPam½ | 4,3 MPam½ |
| E-Modul | 350 GPa | 406 GPa |
| Vickershärte HV1 | 1620 MPa | 2000 MPa |
Verwendung
[Bearbeiten | Quelltext bearbeiten]Über 70 % der Weltjahresproduktion von rund 120 Millionen Tonnen Aluminiumoxid im Jahre 2016 gingen in die Gewinnung von metallischem Aluminium (Hall-Héroult-Prozess).[16][17]


Das α-Al2O3 hat eine Mohs-Härte von 9 bis 9,5 und wird unter anderem zu Lagersteinen von Messinstrumenten und Uhren, sowie zu Schleifmitteln verarbeitet. Basis dafür ist häufig das als Nebenprodukt der Aluminothermie anfallende Alundum.
Kalzinierte Aluminiumoxide werden in der Keramik (z. B. in Waschbecken, Hotelgeschirr, schusssicherer Bekleidung) oder im weitesten Sinn als Poliermittel (z. B. in Glaskeramikreinigern, Autopflegemitteln, Bremsbelägen, Zahnpasten) verwendet, oftmals unter Angabe der Bezeichnung Poliertonerde. Weiterhin dient gesintertes α-Al2O3 (Sinterkorund) als feuerfestes Material in Ofenauskleidungen oder Laborgeräten.
Mit Verunreinigungen durch geringe Mengen an Cr2O3 beziehungsweise TiO2 bildet der Korund die Edelsteine Rubin (Uhrensteine, Ziehsteine, Rubinlaser) und Saphir.
Mit Ti2O3 dotierte Al2O3-Einkristalle bilden das Herzstück des Titan:Saphir-Lasers.
γ-Al2O3 dient als Adsorbens und als Katalysatorträger, sowie als Katalysator selbst.
In der Elektrotechnik wird Aluminiumoxid-Keramik wegen ihres geringen dielektrischen Verlustfaktors als Dielektrikum eingesetzt. Haupteinsatzbereich ist dabei die Realisierung von Streifenleitungen und Kondensatoren in der Hochfrequenztechnik. Aluminiumoxid-Keramikplatten dienen auch als Substrat für die Dickschichttechnik, Dünnschichttechnologie und für Platin-Temperaturmesswiderstände (siehe PT100). Die gute Metallisierbarkeit dieser Keramik ermöglicht auch das direkte Auflöten elektronischer Bauelemente wie Widerstände oder LEDs. Die Keramik fungiert dabei auch gleichzeitig als Kühlkörper. Diese Keramik-Elektroniksysteme sind genauso wirksam wie Systeme, die metallische Kühlkörper enthalten. Auch zur Herstellung von Sicherungskörpern werden Aluminiumoxide verwendet.
Die hohe Durchschlagsfestigkeit und maximale Betriebstemperatur von bis zu 1900 °C machen Aluminiumoxid zum idealen Isolator für Zündkerzen.
Im Anlagen- und Maschinenbau wird Aluminiumoxidkeramik insbesondere zum Verschleiß- und Korrosionsschutz eingesetzt. So werden zum Beispiel Transportrinnen und Rutschen, Trommelmühlen und Mischer mit Kacheln aus Hochleistungskeramik ausgekleidet, um die Standzeiten der Anlagen zu erhöhen. Die Korrosionsbeständigkeit von Glasoberflächen lässt sich durch eine Beschichtung aus Aluminiumoxid deutlich erhöhen.[18] Auch beim Plasma-Schweißen haben sich Düsen aus Aluminiumoxid bewährt. Aufgrund der guten tribologischen Eigenschaften haben sich insbesondere Bauteile wie Dicht- und Regelscheiben, Lagerbuchsen und -wellen, Fadenführer in der Textilindustrie sowie Hüftgelenkskugeln und Pfannen in der Endoprothetik bewährt. Innovativ ist auch der Einsatz von Keramiknoppen in der Anlaufspur von Skisprungschanzen.
Hochreine, großkristalline und daher transparente Aluminiumoxid-Keramik dient der Herstellung von Brennerrohren von Hochdruck-Gasentladungslampen (Natriumdampflampen, Halogen-Metalldampflampen). Früher verwendete man es auch als Ultraviolett-transparentes Fenstermaterial für EPROMs.
Neueste Sinterverfahren machen es möglich, Aluminiumoxid zur Herstellung extrem fester nanoskaliger Glaskeramiken einzusetzen, z. B. bei Armbanduhrengläsern.[19]
In letzter Zeit werden Al2O3-Keramiken auch in Panzerungen von Fahrzeugen verwendet.[20] Die Keramikkacheln werden dabei auf ein Aramid- bzw. Dyneema-Gewebe geklebt. Diese Art der Panzerung erreicht bei einem gleichen Flächengewicht die doppelte Schutzwirkung von Panzerstahl. Die Keramik fragmentiert das Geschoss, die Aramid-Fasern fangen anschließend die Bruchstücke auf.
Al2O3 wird mit der Bezeichnung Elektrokorund (ELK) als Edelkorund, Halbedelkorund und Normalkorund in den Handel gebracht. Es wird in einem elektrischen Ofen bei etwa 2.000 °C hergestellt. Der dabei entstehende Schmelzkuchen wird zerschlagen und nach in der DIN festgelegten Körnungen abgesiebt. Edelkorund wird in der Technik als Schleifmittel bei Herstellung von Schleifscheiben verwendet. Es wird auch als Strahlmittel und als Polierpulver verwendet.
Weitere Aluminiumoxide
[Bearbeiten | Quelltext bearbeiten]Neben dem dreiwertigen Aluminiumoxid sind noch zwei weitere Aluminiumoxide in niedrigeren Oxidationsstufen, Aluminium(I)-oxid und Aluminium(II)-oxid bekannt. Diese sind jedoch nur bei hohen Temperaturen in der Gasphase stabil.[21]
Siehe auch
[Bearbeiten | Quelltext bearbeiten]Weblinks
[Bearbeiten | Quelltext bearbeiten]Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu ALUMINA in der CosIng-Datenbank der EU-Kommission, abgerufen am 12. Februar 2020.
- ↑ a b c d e f Datenblatt Aluminiumoxid bei Merck, abgerufen am 20. Februar 2007.
- ↑ refractiveindex.info: Refractive index of Al2O3 (Aluminium oxide)
- ↑ a b c Eintrag zu Aluminiumoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 1344-28-1 bzw. Aluminiumoxid), abgerufen am 2. November 2015.
- ↑ PAETEC Formelsammlung Ausgabe 2003, S. 116.
- ↑ a b c d Karl Wefers, Chanakya Misra: Oxides and Hydroxides of Aluminum. In: Alcoa Technical Paper. Band 19, 1987, S. 92 (englisch, researchgate.net [PDF; 6,2 MB; abgerufen am 19. März 2024]).
- ↑ BAUXITE AND ALUMINA. (PDF 29,2 kB S. 2) USGS, abgerufen am 16. April 2016 (englisch).
- ↑ J. W. Newsome, H. W. Heiser, A. S. Russell, H. C. Stumpf: ALUMINA PROPERTIES. In: Alcoa Technical Paper. Band 10, 1960, S. 88 (englisch, osti.gov [PDF; 6,7 MB; abgerufen am 19. März 2024]).
- ↑ I. V. Pekov, I. P. Anikin, N. V. Chukanov, D. I. Belakovskiy, V. O. Yapaskurt, E. G. Sidorov, S. N. Britvin & N. V. Zubkova: Deltalumite, a new natural modification of alumina with spinel-type structure - PDF (Russian). In: PROCEEDINGS OF THE RUSSIAN MINERALOGICAL SOCIETY. Band 148, Nr. 5, 2019, S. 45–59, doi:10.30695/zrmo/2019.1485.02 (englisch).
- ↑ Diaoyudaoit. In: Mineralienatlas Lexikon. Geolitho Stiftung
- ↑ Aluminiumoxidkeramik DIN EN 60 672, Typ C799. ( vom 11. Oktober 2012 im Internet Archive) (PDF; 55 kB). Metoxit AG, Januar 2007, abgerufen am 19. August 2010.
- ↑ a b W. Martienssen, Hans Warlimont: Springer handbook of condensed matter and materials data. Springer, 2005, ISBN 3-540-44376-2, S. 438–439, 445–446.
- ↑ U. Seifert: Keramikmodifizierung mittels Laser. Dissertation. Ingenieurhochschule Mittweida, 1989.
- ↑ a b CeramTec: Datenblatt "Werkstoffdaten". ( vom 29. Oktober 2013 im Internet Archive) (PDF; 314 kB)
- ↑ BAUXITE AND ALUMINA. (PDF 28,6 kB S. 2) USGS, abgerufen am 19. November 2018 (englisch).
- ↑ BAUXITE AND ALUMINA. (PDF 25,7 kB S. 2) USGS, abgerufen am 19. November 2018 (englisch).
- ↑ St. Kuhn, R. Linke, Th. Hädrich: Modification of hot glass surface with alumina by combustion CVD. In: Surface & Coatings Technology. 205, 2010, S. 2091–2096.
- ↑ A. Rosenflanz, M. Frey, B. Endres, T. Anderson, E. Richards, C. Schardt: Bulk glasses and ultrahard nanoceramics based on alumina and rare-earth oxides. In: Nature. Band 430, Nr. 7001, 2004, S. 761–764, doi:10.1038/nature02729.
- ↑ Klaus D Linsmeier: Technische Keramik - Werkstoff für höchste Ansprüche. (= Die Bibliothek der Technik. Band 208). 2010, ISBN 978-3-937889-97-9, S. 65ff.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1156.